
分析 (1)自发的进行的放热的氧化还原反应能设计成原电池;
(2)根据电池反应式知,失电子化合价升高的金属作负极,不如该金属活泼的金属或导电的非金属作正极,发生还原反应的可溶性电解质为该原电池的电解质,该原电池中,负极上Cu失电子发生氧化反应;
(3)负极铜发生氧化反应,原电池中阴离子向负极移动.
解答 解:(1)自发的进行的放热的氧化还原反应能设计成原电池,A不是氧化还原反应,所以不能设计成原电池,B是自发进行的放热的氧化还原反应,所以能设计成原电池,故答案为:B;
(2)根据电池反应式知,失电子化合价升高的金属作负极,不如该金属活泼的金属或导电的非金属作正极,发生还原反应的电解质为该原电池的电解质,所以Cu作负极,正极可以是Ag、石墨等,可溶性铁盐溶液作电解质溶液,如FeCl3溶液或Fe2(SO4)3溶液,
故答案为:铜(Cu);石墨(C);FeCl3溶液或Fe2(SO4)3溶液;
(3)负极铜发生氧化反应,电极反应式为:Cu-2e-=Cu2+,原电池中阴离子向负极移动,故答案为:Cu-2e-=Cu2+;氧化;负.
点评 本题考查原电池设计,侧重考查学生实验设计能力,明确原电池原理是解本题关键,电池反应中发生氧化反应的金属作负极、得电子的可溶性电解质作原电池的电解质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 上述反应的化学反应速率关系:2 v(NH3)=3 v(H2O) | |
| B. | 若在2L的密闭容器中反应,经过3min后NH3的物质的量由10mol变为7mol则v (NH3)=0.5mol•L-1•s-1 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若降低温度,反应速率将会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
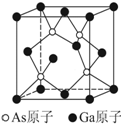 氮族元素和硼族元素在生产生活中有很重要的地位.
氮族元素和硼族元素在生产生活中有很重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| C. | ${\;}_{2}^{3}$He原子核内含有3个中子 | |
| D. | ${\;}_{2}^{4}$He最外层电子数为2,具有较强金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COOH 溶液加水稀释后,溶液中C(OH-)减小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Cl$→_{H_{2}O}^{NaOH}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Cl$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Cl$→_{醇}^{NaOH}$CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Cl$→_{醇}^{NaOH}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


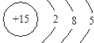 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com