
【题目】下列各组元素性质的递变情况错误的是 ( )
A. Li、Be、B原子最外层电子数依次增多
B. P、S、Cl元素最高正价依次升高
C. N、O、F电负性依次增大
D. Na、K、Rb第一电离能逐渐增大
科目:高中化学 来源: 题型:
【题目】pH=2.1 的两种酸溶液 A、B 各 1mL,分别加水稀释到 100mL,其 pH 与溶液体积的关系如图,下列说法不正确的是( )
A.若 a<4.1,则 A、B都是弱酸
B.
C.
D.
A.若 a<4.1,则 A、B都是弱酸
B.稀释后,A 酸溶液的酸性比B酸溶液强
C.若 a=4.1,则 A 是强酸,B是弱酸
D.A、B两种酸溶液的物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】积极保护生态环境可实现人与自然的和谐共处.
①下列做法会加剧温室效应的是(填字母).
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是(填字母).
a.使用可降解塑料 b.露天焚烧废弃塑料 c.直接填埋废弃塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹.“禁止燃放烟花爆竹”的标识是(填字母).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。

若“重整系统”发生的反应中![]() =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。

①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1)![]() H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5 |
Ka1(H2CO3) | 4×10-7 |
Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O![]() NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以异丁烯为原料合成某二酸的合成路线如下:

已知:R-CH2CN![]() R-CH2COONa+NH3
R-CH2COONa+NH3
(1)A的系统命名是_______________,B的官能团名称是_______________________。
(2)步骤③的反应类型是____________________________。
(3) 同一有机物中的两个同种官能团在反应时,一者参与反应占绝大多数,另一者几乎不反应,这被称之为“位置专一性”。请从反应物结构角度,简要解释步骤②中消去氯原子时的位置专一性:______________________________。
(4)步骤⑤的产物C经酸化后,可发生分子内酯化,写出该内酯的结构简式______________________。
(5)写出步骤⑥的化学方程式___________________________________。
(6)均符合下列条件B的同分异构体有________个。
a.所有碳原子一定共平面; b.核磁共振氢谱有3 组峰。
(7)利用题目给的信息,写出由异丁烯为原料,两步合成 的路线流程______。
的路线流程______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: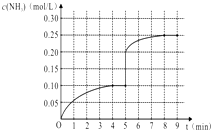
(1)该反应的化学平衡常数表达式为;
(2)根据如图,计算从反应开始到平衡时(4分钟末),平均反应速率v(N2)= .
(3)该反应达到平衡状态的标志是(填字母);
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.3v正(H2)=2v逆(NH3)
e.容器中混合气体的密度保持不变
(4)在第5分钟末改变某一条件后,在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),达到新平衡时NH3浓度的变化曲线如上图.则第5分钟末改变的条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①CH3COOH ②Na2C2O4③NaCl ④NaOH⑤NH4Cl.回答问题:
(1)H2C2O4是弱酸,则②溶液中盐水解的离子方程式为;
(2)浓度均为 0.1molL﹣1 的④、⑤溶液等体积混合后,c(Na+)+c(NH4+)+c(NH3H2O)=;
(3)常温下,pH都为4的①、⑤溶液中水电离出的c(OH﹣)的比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com