
【题目】NA代表阿伏伽德罗常数的值,下列叙述正确的是
A.1 L 1 mol/L FeBr2溶液与1 mol氯气反应时转移的电子数为3NA
B.0.5 mol/L硫酸钠溶液中含有溶质离子总数为1.5NA
C.1 mol硫酸氢钠固体中含阳离子总数NA
D.28 g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数为NA
【答案】C
【解析】
试题分析:A.1 mol的Cl2与1 L 1 mol/L FeBr2溶液发生反应,由于FeBr2的阳离子、阴离子都具有还原性,二者发生反应时,Cl2不足量,反应转移电子数以氯气为标准计算,转移电子数目为2NA,故A错误;B.题目没有给出溶液的体积,无法计算溶液中含有的溶质的物质的量及微粒数目,故B错误;C.硫酸氢钠是离子化合物,在熔融状态的电离方程式是:NaHSO4==Na++HSO![]() ,1 mol硫酸氢钠固体中含阳离子总数NA,故C正确;D.28 g乙烯物质的量是1 mol,含有1 mol碳碳双键,而聚乙烯中无碳碳双键,所以在28 g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数小于NA,故D错误。
,1 mol硫酸氢钠固体中含阳离子总数NA,故C正确;D.28 g乙烯物质的量是1 mol,含有1 mol碳碳双键,而聚乙烯中无碳碳双键,所以在28 g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数小于NA,故D错误。


科目:高中化学 来源: 题型:
【题目】下列实验操作的描述中,正确的是()
A. 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物
C. 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量
D. 利用丁达尔效应可以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH![]() 数目增多 ④c(OH-)增大 ⑤导电性增强
数目增多 ④c(OH-)增大 ⑤导电性增强
A.①②③ B.①③⑤ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿泉水标签上印有主要的矿物质成分如下(单位为mg/L):Ca 20,K 39,Mg 3,Zn 0.06,F 0.02等,这里的 Ca,K,Mg,Zn,F是指 ( )
A. 单质 B. 元素 C. 金属离子 D. 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案不能达到实验目的的是
A. 用碘水鉴别淀粉溶液和食盐水
B. 用澄清石灰水鉴别Na2CO3和NaHCO3溶液
C. 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体
D. 除去Cl2中HCl,将混合气体依次通过饱和食盐水和浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国农业因遭受酸雨而造成的损失每年高达15亿元以上。为了有效控制酸雨,目前国务院已颁布了多项法规。以下各种物质哪种与酸雨的形成无关 ( )
A. SO2 B. NO C. NO2 D. CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选修3——物质结构与性质
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐),A晶体的晶胞为正方体(如图1)。
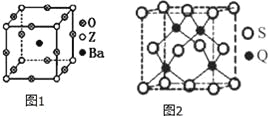
①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B,B晶体的晶胞为正方体(如图2),若晶胞棱长为5.4×10-8cm,则晶胞密度为 gcm﹣3(列式并计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的说法正确的是( )
A.热稳定性:HCl<HBr<HI
B.原子半径:K<Na<Li
C.熔点:Cl2>Br2>I2
D.氧化性:Cl2>Br2>I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com