
| A. | 凡能导电的物质一定是单质 | |
| B. | 金属单质都能与稀硫酸发生置换反应 | |
| C. | 在化学反应中,金属单质失电子,常作还原剂 | |
| D. | 活泼金属都能从盐溶液中置换出较不活泼的金属 |
分析 A.能导电的物质不一定是单质,可能是化合物或混合物;
B.在金属活动性顺序表中H之前的金属能和稀硫酸发生置换反应;
C.在化学反应中,金属单质易失电子而作还原剂,体现还原性;
D.活泼金属不一定从盐溶液中置换出较不活泼的金属.
解答 解:A.能导电的物质布一定是单质,可能是化合物或混合物,如熔融氯化钠、稀硫酸等,故A错误;
B.在金属活动性顺序表中H之前的金属能和稀硫酸发生置换反应,如Cu和稀硫酸不反应,故B错误;
C.在化学反应中,金属单质最外层电子数小于4,易失电子而作还原剂,体现还原性,故C正确;
D.活泼金属不一定从盐溶液中置换出较不活泼的金属,如钠和盐溶液反应时先和水反应,然后生成的NaOH再和较不活泼的盐溶液发生复分解反应,故D错误;
故选C.
点评 本题考查金属活泼性强弱顺序,明确金属原子结构、金属的性质即可解答,熟练掌握金属活动性顺序表,易错选项是D.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 两试管各加入5ml 0.1mol/L Na2S2O3溶液,同时分别滴入5ml 0.1mol/L硫酸和盐酸 | 两支试管同时变浑浊 | 其它条件不变时,Cl-一定有催化效果 |
| C | A1箔插入稀HNO3中 | 无现象 | A1箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中加稀盐酸入:HCO3-+H+═CO2↑+H2O | |
| B. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时:电子移动方向由Pb通过导线向PbO2传递 | |
| B. | 充电时:阳极反应是PbSO42-+2e-+2H2O═PbO2+SO42-+4H+ | |
| C. | 放电时:正极反应是Pb-2e-+SO42-═PbSO4 | |
| D. | 充电时:铅蓄电池的阴极应与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: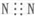 | |
| B. | S2-的结构示意图: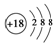 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{58}^{131}$I | |
| D. | 乙烯的分子式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是在化学合成中将原子充分利用,转化为新的原子 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 高纯度的晶体桂可以制备晶体管等半导体、电脑芯片 | |
| D. | 酒精、NaCl溶液、CuSO4溶液、浓HNO3都可使蛋白质发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
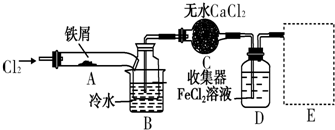
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com