
有一种气体的质量是14.2g,体积是4.48升(标准状况),该气体的摩尔质量是 ( )
A.28.4 g B.28.4g·mol-1 C.71 g·mol-1 D.71 g
科目:高中化学 来源: 题型:
将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下可逆反应:2A(g)+B(g)⇌2C(g).若经2s后测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是( )
A. 反应达到平衡时,A、B、C的浓度不再变化,反应停止
B. 升高温度、增大压强、增加A的浓度、减小C的浓度或使用催化剂等都可以使反应速率加快
C. 经过足够长时间后,A和B可以完全转化为C
D. 2s时物质A转化了1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Ni(OH)2
开始沉淀pH 3.4 1.8 7.5 7.2
完全沉淀pH 5.2 3.2 9.7 9.2
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 .
(2)“碱浸”过程中发生的离子方程式是
(3)“酸浸”时所加入的酸是 (填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是: .
(5)“调pH为2~3”的目的是
(6)操作c的方法是:
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2NO(g)⇌O2(g)+N2(g);△H=﹣180kJ.mol﹣1,对此反应的逆反应,下列说法正确的是( )
|
| A. | 升高温度平衡常数K增大 |
|
| B. | 升高温度平衡常数K减小 |
|
| C. | 增大压力则平衡移动 |
|
| D. | 增大N2浓度,则NO分解率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中盛有HI气体,在400℃时建立如下平衡:2HI(g)⇌H2 (g)+I2 (g);△H>0,改变下列条件,请填空:(填写变化情况)
(1)将温度升至480℃,混合气体的颜色 ,(加深,变浅、不变)HI的分解率 ,(增大、减小、不变),化学平衡向 移动,平衡常数 (增大、减小、不变),混合气体的总质量 (增大、减小、不变);
(2)若将密闭容器的体积压缩了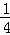 ,平衡常数 (增大、减小、不变)
,平衡常数 (增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法错误的是 ( )
A. NA 个OH-  含有电子10mol
含有电子10mol
B.某元素R一个原子的质量是ag,则其的相对原子质量可表示为a NA,
C.4L0.5mol/L的NaOH溶液中含有阴离子的数目为2NA
D.配制一定物质的量浓度的 NaOH溶液时,定容时俯视操作所得溶液浓度偏低
NaOH溶液时,定容时俯视操作所得溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①可以判断该分解反应已经达到平衡的是________(填字母序号)。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时的分解平衡常数:____________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH____0(填“>”、“=”或“<”),熵变ΔS____0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2ONH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如下图所示。
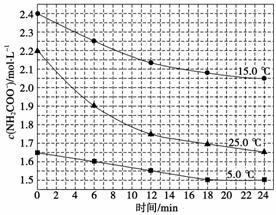
①计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:__________。
②根据图中信息,如何说明该水解反应速率随温度升高而增大:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤族元素随核电荷数的增加,下列叙述正确的是( )
A. 单质的颜色逐渐加深
B. 气态氢化物的稳定性逐渐增强
C. 单质的熔点逐渐升高
D. 单质的氧化性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com