NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.物质的量浓度为0.5mol/LMgCl2溶液,含有氯离子数为NA
B.25℃、1.01×105Pa时,22gCO2中含有1.5NA个原子
C.46gNO2与N2O4混合气体中含有原子数为3NA
D.将98gH2SO4溶解于500mL水中,所得溶液中H+的物质的量浓度为4mol/L
【答案】
分析:A、未明确溶液体积;
B、根据质量、摩尔质量、分子数、一个分子含有的原子数、阿伏伽德罗常数之间的关系式计算判断;
C、采用归一法进行计算;
D、根据物质的量浓度公式判断.
解答:解:A、0.5mol/LMgCl
2溶液,未明确溶液体积,无法确定氯离子数,故A错误;
B、只要物质确定,其摩尔质量为定值,与条件无关,22gCO
2中含有原子数为N=
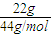
×3×N
Amol
-1=1.5N
A,故B正确;
C、混合气体存在一个可逆反应的平衡状态2NO
2?N
2O
4.但是,NO
2与N
2O
4的氮质量分数相同ω(N)=

,N原子和O原子个数之比都是1:2,反应前后的原子个数没有改变,因此,可以把46gNO
2与N
2O
4混合气体看作纯粹的NO
2或者纯粹的N
2O
4,以看成是46gNO
2计算,则原子数为N=

×3×N
Amol
-1=3N
A,故C正确;
D、将98gH
2SO
4溶解于500mL水中,溶剂水的体积是500mL,溶液的体积不是500mL,故D错误;
故选BC.
点评:注意:
1、C=

,V指溶液体积非溶剂体积;
2、NO
2与N
2O
4的氮质量分数相同,所以可采用归一法求解.

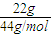 ×3×NAmol-1=1.5NA,故B正确;
×3×NAmol-1=1.5NA,故B正确; ,N原子和O原子个数之比都是1:2,反应前后的原子个数没有改变,因此,可以把46gNO2与N2O4混合气体看作纯粹的NO2或者纯粹的N2O4,以看成是46gNO2计算,则原子数为N=
,N原子和O原子个数之比都是1:2,反应前后的原子个数没有改变,因此,可以把46gNO2与N2O4混合气体看作纯粹的NO2或者纯粹的N2O4,以看成是46gNO2计算,则原子数为N= ×3×NAmol-1=3NA,故C正确;
×3×NAmol-1=3NA,故C正确; ,V指溶液体积非溶剂体积;
,V指溶液体积非溶剂体积;
