
分析 (1)因K2Cr2O7具有氧化性,C具有还原性,再根据电子守恒和质量守恒定律来分析;
(2)含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,氧化剂被还原;
(3)含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂;
(4)根据每生成3molCO2时转移的电子为12mol来计算.
解答 解:(1)因几种物质中K2Cr2O7具有氧化性,K2Cr2O7在反应中得到电子,而C具有还原性,
氧化反应为C→CO2,还原反应为K2Cr2O7→Cr2(SO4)3,
则反应物为C、H2SO4、K2Cr2O7,生成物为CO2、K2SO4、Cr2(SO4)3和H2O,
由电子守恒及质量守恒定律可知,
配平后的该氧化还原反应的方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,
故答案为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O;
(2)因碳元素的化合价升高,则C为还原剂,Cr元素的化合价降低,则K2Cr2O7为氧化剂,Cr被还原,对应的还原产物为Cr2(SO4)3,
故答案为:C;Cr;
(3)含元素化合价升高的物质为还原剂,则C为还原剂,含元素化合价降低的物质为氧化剂,则K2Cr2O7为氧化剂,则氧化剂和还原剂物质的量之比为3:2;
故答案为:3:2;
(4)由3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O可知,每生成3molCO2时转移的电子为12mol,
则电子转移了1mol时生成的CO2的物质的量为0.25mol,其体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6L.
点评 本题考查氧化还原反应,明确常见的氧化剂、还原剂及反应中元素的化合价变化是解答本题的关键,难度不大,对氧化还原反应的考查点较全.


科目:高中化学 来源: 题型:选择题
| A. | 烷烃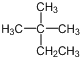 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| C. | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其原理相同 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向氯化铝溶液中加入过量的氨水 | |
| B. |  向饱和石灰水中通入过量的CO2气体 | |
| C. |  向MgCl2、AlCl3的混合液中逐滴加入NaOH溶液至过量 | |
| D. |  向含少量NaOH的偏铝酸钠溶液中通入过量的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+→Ag+→H+ | B. | Ag+→Ba2+→H+ | C. | H+→Ba2+→Ag+ | D. | H+→Ag+→Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L 水中含有的分子数为0.5NA | |
| B. | 标准状况下,22.4LN2中含有的原子数为NA | |
| C. | 23g Na与足量H2O反应转移的电子数为NA | |
| D. | 物质的量浓度为1 mol•Lˉ1的K2SO4溶液中,含2 NA个K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
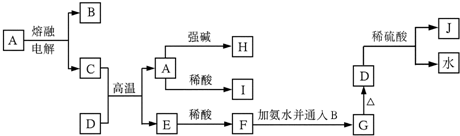
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
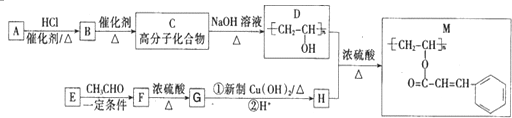
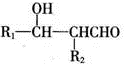
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
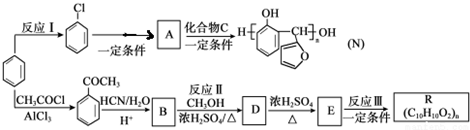
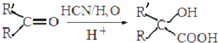
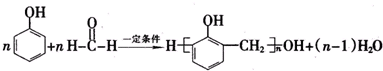
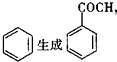 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•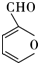
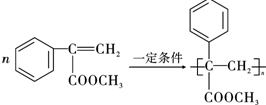
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com