
分析 高温下加热84gA分解产生0.5mol的离子化合物B和44.8L的气体C(标准状况下),C能使湿润的红色石蕊试纸变蓝,则C为NH3,由元素守恒可知A含有N、H元素,A含有三种短周期元素,其中一种元素的原子最外层电子数等于最内层电子数,最外层电子数为2,处于ⅡA族,A、B发生水解反应均产生同一种白色沉淀和气体C,离子化合物B化学式符合M3N2,分解生成氨气为$\frac{44.8L}{22.4L/mol}$=2mol,0.5mol B的质量为84g-2mol×17g/mol=50g,B的相对分子质量为$\frac{50}{0.5}$=100,则M的相对原子质量为$\frac{100-14×2}{3}$=24,故M为Mg,B为Mg3N2,A、B水解均得到氢氧化镁与氨气,可推知A为Mg(NH2)2,据此解答.
解答 解:高温下加热84gA分解产生0.5mol的离子化合物B和44.8L的气体C(标准状况下),C能使湿润的红色石蕊试纸变蓝,则C为NH3,由元素守恒可知A含有N、H元素,A含有三种短周期元素,其中一种元素的原子最外层电子数等于最内层电子数,最外层电子数为2,处于ⅡA族,A、B发生水解反应均产生同一种白色沉淀和气体C,离子化合物B化学式符合M3N2,分解生成氨气为$\frac{44.8L}{22.4L/mol}$=2mol,0.5mol B的质量为84g-2mol×17g/mol=50g,B的相对分子质量为$\frac{50}{0.5}$=100,则M的相对原子质量为$\frac{100-14×2}{3}$=24,故M为Mg,B为Mg3N2,A、B水解均得到氢氧化镁与氨气,可推知A为Mg(NH2)2.
(1)A受热分解的化学方程式:3Mg(NH2)2$\frac{\underline{\;高温\;}}{\;}$4NH3↑+Mg3N2,因氨气极易溶于水,不能用排饱和氯化铵溶液的方法收集氨气,
故答案为:3Mg(NH2)2$\frac{\underline{\;高温\;}}{\;}$4NH3↑+Mg3N2;否;因氨气极易溶于水;
(2)在微电子工业中,氨气的水溶液可做刻蚀剂H2O2的清除剂,所发生的产物不污染环境,反应生成氮气与水,反应方程式为:2NH3•H2O+3H2O2═N2↑+8H2O,
故答案为:2NH3•H2O+3H2O2═N2↑+8H2O;
(3)NH3连续氧化可以产生2种常见气体,它们是制备硝酸的中间产物,分别为NO、NO2,将这两种氧化物按物质的量1:1溶于冰水可以得到一种弱酸D为HNO2,其酸性比醋酸略强,则其酸性比较碳酸强,不能由二氧化碳与NaNO2溶液反应得到,由于HNO2氧化性比I2强,NaNO2溶液溶液通入二氧化硫,会将二氧化硫氧化,不能得到HNO2,可以用盐酸、硫酸与NaNO2反应得到HNO2,
故选:ac.
点评 本题考查无机物推断,物质的性质、反应现象、原子结构特点为推断突破口,侧重考查学生分析推理能力,难度中等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:多选题
| A. | c(B2-)+c(HB-)+c(H2B)=0.1 mol/L | B. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | ||
| C. | c(OH-)=c(H+)+c(HB-) | D. | c(Na+)=2c(B2-)+c(HB-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醚有2种,醇有3种 | B. | 醚有3种,醇有3种 | C. | 醚有3种,醇有4种 | D. | 醚有2种,醇有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硫酸吸收二氧化硫中混有少量SO3气体 | |
| B. | 除去NaCl晶体中少量KNO3,可以将混合物制成热的饱和溶液,然后冷却结晶,过滤 | |
| C. | HClO溶液有漂白性,无法用pH试纸或pH计测得0.1mol/L的HClO溶液的pH值 | |
| D. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2~3次的实验平均值等措施,已达到良好的实验结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、NO3-、K+、Na+ | B. | H+、Fe3+、SO42-、Cl- | ||
| C. | K+、Ba2+、Cl-、CO32- | D. | Al3+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


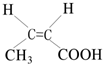 .
. .
.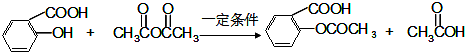 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com