
分析 (1)铵根离子水解显酸性;
(2)托盘天平的感量为0.1g;
(3)需要碱中和甲酸;
(4)NO3-不参加反应,但与NH4+的物质的量比为1:1;
(5)结合4NH4++6HCHO═3H++6H2O+(CH2)6N4H+及H++OH-=H2O计算;
(6)设电离的一水合氨为x,则
NH3.H2O?NH4++OH-,
C 0 0
转化 x x x
平衡 C-x x x
Kb=$\frac{x×x}{C-x}$,以此来解答.
解答 解:(1)硫酸铵水溶液呈酸性的原因是NH4++H2O═NH3•H2O+H+,故答案为:NH4++H2O═NH3•H2O+H+;
(2)托盘天平的感量为0.1g,不能称量1.800g (NH4)2SO4,故答案为:否;
(3)步骤③加入的甲醛溶液使用前需要加入一定量的NaOH,原因是少量甲醛被空气中的氧气氧化为甲酸,需加碱中和,
故答案为:少量甲醛被空气中的氧气氧化为甲酸,需加碱中和;
(4)NH4NO3中NO3-不参加反应,但与NH4+的物质的量比为1:1,可以利用此法测定氮的百分含量,
故答案为:是;因为NO3-不参加反应,但与NH4+的物质的量比为1:1可计算N的百分含量;
(5)由4NH4++6HCHO═3H++6H2O+(CH2)6N4H+及H++OH-=H2O可知存在4NH4+~3NaOH,则样品中氮的百分含量为$\frac{0.027L×0.1mol/L×\frac{4}{3}×\frac{250mL}{25mL}×14g/mol}{1.800g}$×100%=21%,故答案为:21%;
(6)设电离的一水合氨为x,则
NH3.H2O?NH4++OH-,
C 0 0
转化 x x x
平衡 C-x x x
Kb=$\frac{x×x}{C-x}$,
解得x=$\sqrt{C{K}_{b}}$,则
该氨水的电离度a=$\frac{x}{C}$=$\frac{\sqrt{C{K}_{b}}}{C}$=$\sqrt{\frac{{K}_{b}}{C}}$,
在恒定温度下,能得出的结论为温度恒定,加水稀释溶液时,Kb不变,电离度增大,
故答案为:$\sqrt{\frac{{K}_{b}}{C}}$;温度恒定,加水稀释溶液时,Kb不变,电离度增大.
点评 本题考查物质含量的测定,为高频考点,把握发生的反应、含量计算及电离度计算为解答的关键,侧重分析与实验、计算能力的考查,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-269.8kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP (AgCl)<KSP (AgBr) | |
| C. | 将0.001 mol•L- 1 的AgNO3 溶液滴入0.001 mol•L- 1 的KCl和0.001 mol•L- 1 的K2CrO4 溶液中先产生Ag2CrO4 沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
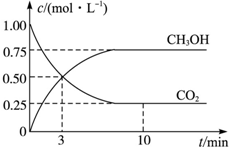 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为△H=-285.8 kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2 H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com