
【题目】下列关于有机化合物结构的说法错误的是( )
A.一氯乙烷有两种同分异构体B.苯分子中六个碳碳键键长完全相等
C.乙烯分子中所有原子处于同一平面内D.乙醇的核磁共振谱图中有3个特征峰
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】17.1 g物质A在氧气中充分燃烧有白雾现象,产物有三种,其中CO2和H2O的质量比为44:9。将等质量的A与钠混合熔融,把产物溶于足量稀硝酸后,加入足量AgNO3溶液,得到18.8 g淡黄色沉淀。物质A的蒸气对相同条件下氢气的相对密度为85.5。已知它不能使溴的CCl4溶液褪色,但能使酸性KMnO4溶液褪色。写出A的结构简式。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
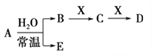
(1)元素⑧的最高价氧化物对应水化物的化学式是_________________________。
(2)元素⑤与As两种元素中,简单气态氢化物较稳定的是___________(填化学式)。
(3)元素②⑥⑦的简单离子半径由大到小的顺序是___________(用化学符号表示)。
(4)元素③的单质与元素②的最高价氧化物对应的水化物反应的离子方程式是________________。
(5)若A为红棕色气体,则X、D的化学式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。

请回答下列问题:
(1)下列相关说法中,正确的是________(填序号)。
a.N4是N2的同分异构体
b.1 mol N4分解生成N2,形成了4 molπ键
c.白磷的沸点比N4高,是因为P-P键键能比N-N键能大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
(2)已知白磷、NH4+ 、N4H44+的空间构型均为四面体结构,参照NH4+和白磷的结构式,画出N4H44+的结构式(配位键用![]() 表示)________________;
表示)________________;
(3)在叶绿素结构示意图上标出N与Mg元素之间的配位键和共价键(配位键用![]() 表示)_______
表示)_______
(4)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。根据等电子体理论写出N3-的电子式_____________;叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是 ________________,写一种与SO42-等电子体的分子 ________________。
(5)六方相氮化硼晶体内B-N键数与硼原子数之比为_______,其结构与石墨相似却不导电,原因是_______________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
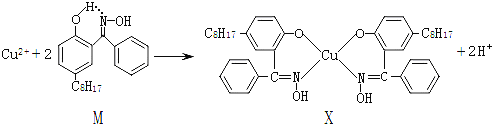
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
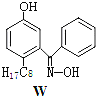
(1)关于M所含元素的说法正确的是______________。
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有_______(填序号)。
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________。
(4)基态Cu2+的外围电子排布图为________________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是_____________________________________________________________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。
①该晶体的化学式为_______________。(用元素符号表示)
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为_______________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
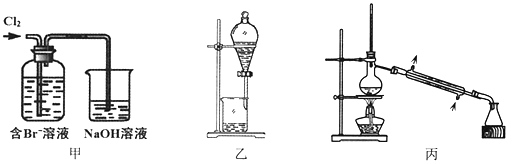
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度是____mol/L,含NaOH的质量____g。
(2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则:
①混合气体的密度是_____。
②混合气体的平均摩尔质量是______。
③CO2和CO的体积之比是_______。
④CO的体积分数是______。
⑤CO2和CO的质量之比是_______。
⑥CO的质量分数是______。
⑦混合气体中所含氧原子的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列说法正确的是( )
A. 1mol乙烷中含有的共价键数目为6NA
B. 14g乙烯中含有的C-H键数目为2NA
C. 0.1molFe与0.1molCl2充分反应,转移的电子数月为0.3NA
D. 0.1molCH4与0.1molCl2经光照充分反应,生成CH3Cl的分子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com