
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: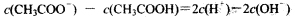 |
B.Na2CO3溶液中,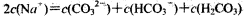 |
C.pH相等的CH3COONa、NaClO、NaHCO3三种溶液: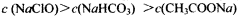 |
D.NH4Cl溶液和NaOH溶液混合所得的中性溶液中: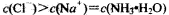 |
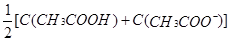 ,将物料守恒代入电荷守恒,消去C(Na+)得出:
,将物料守恒代入电荷守恒,消去C(Na+)得出: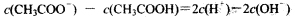 正确。B项,物料守恒写错,应写成:c(Na+) = 2×[c(CO32-) + c(HCO3-) + c(H2CO3);C项,三种盐溶液溶质均水解从而使溶液呈碱性,盐水解后对应的酸越弱,水解程度越大,则碱性越强。现在三种盐溶液的pH相同,盐对应的酸越弱,水解程度越大,则盐的浓度就越小。对应的酸酸性强弱为:CH3COOH>H2CO3>HClO,因此三种盐溶液的浓度大小为:C(CH3COONa)>C(NaHCO3)>C(NaClO),错误。D项,混合后根据电荷守恒:
正确。B项,物料守恒写错,应写成:c(Na+) = 2×[c(CO32-) + c(HCO3-) + c(H2CO3);C项,三种盐溶液溶质均水解从而使溶液呈碱性,盐水解后对应的酸越弱,水解程度越大,则碱性越强。现在三种盐溶液的pH相同,盐对应的酸越弱,水解程度越大,则盐的浓度就越小。对应的酸酸性强弱为:CH3COOH>H2CO3>HClO,因此三种盐溶液的浓度大小为:C(CH3COONa)>C(NaHCO3)>C(NaClO),错误。D项,混合后根据电荷守恒: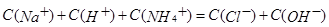 再根据物料守恒:
再根据物料守恒: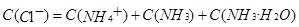 又因为溶液呈中性,
又因为溶液呈中性,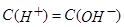 ,根据两个守恒:
,根据两个守恒: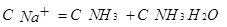 因此:C(Cl-)>C(Na+)>C(NH3·H2O),D项错误。
因此:C(Cl-)>C(Na+)>C(NH3·H2O),D项错误。

科目:高中化学 来源:不详 题型:单选题
| A.Fe3+、H+、SO42-、ClO- | B.Fe3+、Fe2+、SO42-、OH- |
| C.Al3+、Na+、SO42-、HCO3- | D.K+、H+、I-、MnO4- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,pH = 7的氨水与氯化铵的混合溶液中:c(Cl-) = c(NH4+) |
| B.常温下pH = 5的盐酸溶液稀释1000倍后pH = 8 |
| C.在BaSO4的饱和溶液中加入一定量Na2SO4固体,BaSO4的溶解度和Ksp均变小 |
| D.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al3+、Na+、HCO3-、Cl- | B.Fe3+、NO3-、Cl-、SO42- |
| C.Na+、H+、SO32-、NO3- | D.SiO32-、Na+ 、K+、CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
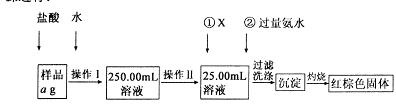
| A.50mL烧杯 | B.50mL量筒 | C.100mL量筒 | D.25mL酸式滴定管 |
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
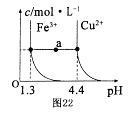
| A.pH=2的溶液:Fe3+、Cu2+、SO42-、NO3- |
| B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2- |
| C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO- |
| D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH =0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B.水电离出的c(H+)=1×10—13mol/L的溶液中: K+、HCO3-、Cl-、S2- |
| C.使pH试纸显深蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| D.在AlCl3溶液中:Na+、AlO2-、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com