
分析 (1)根据电子转移并结合H元素化合价变化计算生成氢气物质的量,再根据V=nVm计算氢气体积;
(2)根据生成氢气物质的量结合反应方程式计算参加反应的盐酸的物质的量;
(3)根据反应方程式结合生成氢气物质的量采用差量法计算溶液增加质量;
(4)根据反应方程式结合生成氢气物质的量计算有多少摩尔锌被氧化.
解答 解:(1)根据电子转移,生成氢气物质的量为$\frac{0.2mol}{2}$=0.1mol,标况下生成氢气体积为0.1mol×22.4L/mol=2.24L,
答:生成标准状况下H2的体积为2.24L;
(2)由(1)计算得到生成氢气为0.1mol,则锌和足量的盐酸反应方程式为:Zn+2HCl=ZnCl2+H2↑,所以参加反应的盐酸的物质的量为0.1mol×2=0.2mol,
答:参加反应的盐酸的物质的量为0.2mol;
(3)锌和足量的盐酸反应方程式为:Zn+2HCl=ZnCl2+H2↑△m
1mol 65-2=63g
0.1mol 6.3g
答:溶液增加质量为6.3g;
(4)由(1)计算得到生成氢气为0.1mol,则锌和足量的盐酸反应方程式为:Zn+2HCl=ZnCl2+H2↑,所以有0.1mol锌被氧化;
答:有0.1mol锌被氧化.
点评 本题考查氧化还原反应计算,题目基础性强,难度不大,侧重考查学生分析计算能力.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:多选题
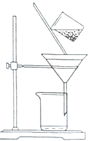
| A. | 漏斗末端颈尖未紧靠烧杯壁 | |
| B. | 玻璃棒用作引流 | |
| C. | 将滤纸湿润,使其紧贴漏斗壁 | |
| D. | 滤纸边缘高出漏斗 | |
| E. | 用玻璃棒在漏斗中轻轻搅动以加快过滤速度. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量就是物质的质量 | |
| B. | 摩尔是国际单位制中七个基本物理量之一 | |
| C. | 物质的量是量度物质所含微粒多少的一个物理量 | |
| D. | 1mol任何物质都含有6.02×1023个微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色沉淀,继续通入CO2气体,白色沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液. |
| B | 某无色晶体加入NaOH浓溶液中并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| C | 用蒸馏法能将溶解在CCl4中的碘单质分离出来 | 因为碘易升华,故蒸馏时先分离出来 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2>F e3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液::K+、Al3+、Cl-、NO3- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿内加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 加入试剂的顺序为Na2CO3、BaCl2、NaOH、HCl | |
| D. | 用过滤法除去粗盐中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
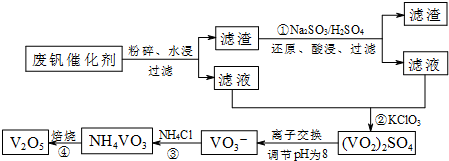
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com