
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 光照条件下1mol CH4与3mol Cl2反应可制得1mol CHCl3 | |
| C. | 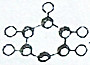 为苯分子的比例模型 为苯分子的比例模型 | |
| D. | HC≡C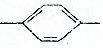 CH═CHCH3中所有碳原子有可能都在同一个平面内 CH═CHCH3中所有碳原子有可能都在同一个平面内 |
分析 A.结构简式不能省略官能团;
B.光照下取代反应为链锁反应;
C.苯分子的比例模型  ;
;
D.苯环为平面结构,三键为直线结构,双键为平面结构,且直接相连.
解答 解:A.乙烯的结构简式为CH2=CH2,故A错误;
B.光照条件下1mol CH4与3mol Cl2反应生成多种卤代烃,故B错误;
C.球棍表示的为球棍模型,而 为苯的比例模型,故C错误;
为苯的比例模型,故C错误;
D.苯环为平面结构,三键为直线结构,双键为平面结构,且直接相连,则所有碳原子有可能都在同一个平面内,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团、结构、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
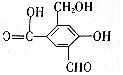 ,试回答下列问题:
,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 戊烷有4种同分异构体 | |
| B. | 乙酸和溴乙烷均可发生加成反应 | |
| C. | 乙烷和乙烯可用酸性KMnO4溶液鉴别 | |
| D. | 皂化反应的产物是高级脂肪酸和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCH3Cl含极性共价键数目为2NA | |
| B. | 0.1L 1.0mol/L Na2S溶液中S2-和HS-总数为0.1NA | |
| C. | 22.4g 铁粉与稀硝酸完全反应时转移的电子数一定为1.2NA | |
| D. | 常温常压下,16g14CH4中所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
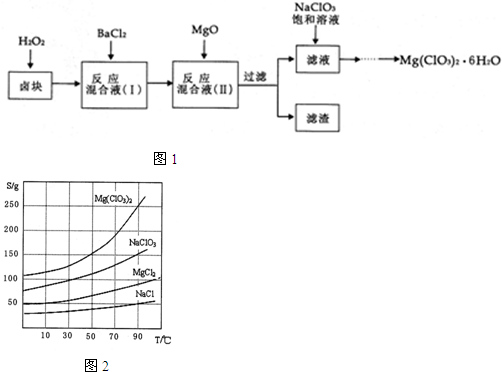
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、SO42-、Cl- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、K+、CO32- | D. | K+、Mg2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
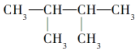 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;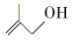 的分子式为C4H8O;
的分子式为C4H8O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com