
设NA表示阿伏伽德罗常数的值。下列说法正确的是( )
A. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA
B. 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5 NA
C. 含0.1molNH4HSO4的溶液中,阳离子数目略小于0.2NA
D. C3H8分子中的2个H原子分别被1个-NH2和1个-OH取代,1mol此有机物所含共用电子对数目为13NA
科目:高中化学 来源:2016-2017学年北京市怀柔区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象不相同的是
A.AlCl3 和NaOH B.Na2CO3和CaCl2
C.NaHCO3和HCl D.NaCl和AgNO3
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)= c(HRO3-)+2c(RO32﹣)
B. 常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C. 常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③
D. 常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液 ②pH=3的HCl溶液 ③pH=11
的氨水中由水电离出的c(H+):①>③>②
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
化学是建立在实验基础上的学科。关于下列各实验装置的叙述中,不正确的是
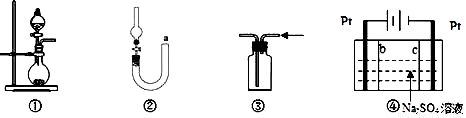
A. 装置①可用于实验室制取少量 NH3 或 O2
B. 可用从 a 处加水的方法检验装置②的气密性
C. 实验室可用装置③收集 H2、NH3
D. 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源:2017届湖北省、襄阳五中、襄阳四中等)高三下学期第二次联考理综化学试卷(解析版) 题型:实验题
I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水
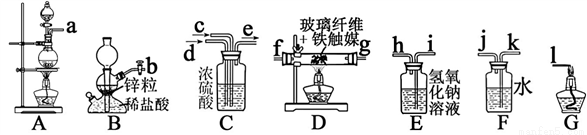
已知:加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____ ______;
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:推断题
A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如下表:
元素 | 相 关 信 息 |
A | 原子核外有7种运动状态不同的电子 |
B | 外围电子排布式为nsnnpn+2 |
C | 常见的金属,在周期表中周期序数与族序数相等 |
D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
E | 一种核素的质量数为56,中子数为30 |
F | 单质紫红色,电缆材料,常见氧化物为黑色 |
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第__族,其高价态离子核外有__个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是______(用离子符号表示).
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为_______
(4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是__________
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为___________________
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是__________;该过程总的离子反应式为________________向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是________
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
密闭容器中有如下反应:mA(g)+nB(g) pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
A.m+n>p B.A的转化率降低
C.平衡向正反应方向移动 D.C的质量分数增加
查看答案和解析>>
科目:高中化学 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:简答题
一水硫酸四氨合铜(II)的化学式为[Cu(NH3)4]SO4·H2O合成路线为:
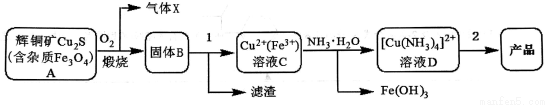
己知:[Cu(NH3)4]2+(aq)  Cu2+(aq)+4NH3(aq) ;(NH4)2SO4在水中可溶,在乙醇中难溶;[Cu(NH3)4]SO4·H2O在乙醇水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下:
Cu2+(aq)+4NH3(aq) ;(NH4)2SO4在水中可溶,在乙醇中难溶;[Cu(NH3)4]SO4·H2O在乙醇水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下:
(1)流程图中气体X的主要成分_______(填化学式),步骤1需要加什么酸_______(填名称)。
(2)有同学提出:从溶液D到产品的步骤2,可以采用的操作方法依次是:加热蒸发、冷却结晶、抽滤、洗涤、干燥。请评价其合理性,并说明理由____________;请另外再提出一种合理的实验方案________(不要求具体的实验步骤)。
(3)抽滤装置如下图所示,该装置中的错误之处是______;抽滤完毕或中途需停止抽滤时,应先______,然后________。

查看答案和解析>>
科目:高中化学 来源:福建省2016-2017学年高一3月月考化学试卷 题型:选择题
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH D.18mol/LH2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com