分析:(1)溶液Ⅰ中含有亚铁离子,酸性条件下,ClO
3-氧化Fe
2+为Fe
3+,本身被还原为Cl
-,根据得失电子相等、电荷守恒、质量守恒配平;
(2)若C为KKO
3和KOH的混合物,与Fe
2O
3加热共融制得高铁酸钾,则缺项物质为K
2FeO
4和H
2O,根据得失电子相等、质量守恒配平;
(3)操作Y为从溶液中获得高铁酸钾,不能直接蒸干,需要通过蒸发浓缩、冷却结晶、过滤后得到粗产品,然后再通过洗涤、干燥获得高铁酸钾;
(4)①反应原理中有碘单质生成和消耗,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点;
②根据反应2Fe
3++2I
-═2Fe
2++I
2、I
2+2S
2O
32-═2I
-+S
4O
62-找出关系式Fe
3+~S
2O
32-,然后根据关系式计算出铁离子的物质的量,再根据c=
计算出铁元素含量;根据双氧水对消耗S
2O
32-的物质的量的影响判断误差;
(5)检验溶液中的Fe
3+可用KSCN溶液,检验溶液中的Fe
2+可用酸性高锰酸钾溶液或K
3[Fe(CN)]
6溶液.
解答:
解:(1)根据题中流程可知,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁,在溶液Ⅰ中含有亚铁离子,酸性条件下,ClO
3-氧化Fe
2+为Fe
3+,本身被还原为Cl
-,根据化合价升降相等配平,配平后的离子方程式为:6Fe
2++ClO
3-+6H
+═6Fe
3++Cl
-+3H
2O,
故答案为:6Fe
2++ClO
3-+6H
+=6Fe
3++Cl
-+3H
2O;
(2)KNO
3和KOH的混合物,写出其与Fe
2O
3加热共融制得K
2FeO
4,则缺项中有一种为K
2FeO
4,K
2FeO
4中铁元素化合价为+6,则亚铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO
3中N元素从+5降为KNO
2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO
3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:1Fe
2O
3+3KNO
3+4KOH=2K
2FeO
4+3KNO
2+2H
2O,
故答案为:1、3、4、2K
2FeO
4、3、2H
2O;
(3)操作Y是从高铁酸钾溶液中获得高铁酸钾固体,正确的方法为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:过滤、洗涤、干燥;
(4)①Fe
3+氧化I
-生成I
2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点,
故答案为:淀粉;溶液由蓝色变无色且保持半分钟不变色;
②由2Fe
3++2I
-═2Fe
2++I
2、I
2+2S
2O
32-═2I
-+S
4O
62-可得:Fe
3+~S
2O
32-,则n(Fe
3+)=n(S
2O
32-)=0.1000mol/L×0.02L=0.002mol,铁元素总含量为:
=5.6g/L;
H
2O
2也能氧化I
-生成I
2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高,
故答案为:5.6;偏高;
(5)由于Fe
3+、Fe
2+共存,所以要分开检验,则检验溶液I中Fe
2+和Fe
3+的方法为:取溶液Ⅰ少量于试管中,加入硫酸酸化,再加入高锰酸钾溶液,溶液颜色从深紫色变成黄色或变浅,则含有Fe
2+(或取溶液Ⅰ少量于试管中,加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe
2+);
另取溶液Ⅰ少量于试管中,滴加硫氰化钾溶液,如果变为红色,证明含有铁离子,
故答案为:先加KSCN溶液,变血红色说明含有Fe
3+,再取样滴加酸化的KMnO
4溶液褪色,说明含有Fe
2+.




 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清. 四座工厂排出的废水里含有的污染物分别为:
如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清. 四座工厂排出的废水里含有的污染物分别为:
 .
.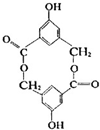 所示,
所示, (M1=142.5)互为相邻同系物,则M(B)可能为128.5
(M1=142.5)互为相邻同系物,则M(B)可能为128.5