
下列说法正确的是( )
A.等物质的量浓度的硫酸氢铵溶液和氢氧化钠溶液等体积混合:
c(S042-)>c(Na+)>C(NH4+)>c(OH-)=c(H+)
B.常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系: c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-)
C.在滴有酚酞溶液的氨水中,加入NH4CI的溶液恰好无色,则此时溶液的PH<7
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,若混合液pH=7,则溶液中:2c(R2-)+c(HR-)=c(Na+)
【知识点】溶液中的离子浓度关系 H2 H6
【答案解析】D 解析:A、等物质的量浓度的硫酸氢铵溶液和氢氧化钠溶液等体积混合:OH-与H+恰好反应,水解是溶液显酸性: c(S042-)=c(Na+)>C(NH4+)>c(H+)>c(OH-),故A错误;B、常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后,所得溶液为等物质的量的HB与NaB的混合溶液,根据溶液的pH=3可知HB的电离大于NaB的水解程度,则溶液中微粒浓度存在下面关系: c(Na+)>c(HB)>c(B-)>c(H+)>c(OH-),故B错误;C、在滴有酚酞溶液的氨水中,加入NH4CI的溶液恰好无色,则此时溶液的PH约为8,故C错误;D、利用电荷守恒:2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),混合液pH=7,即c(OH-)=c(H+),所以2c(R2-)+c(HR-)=c(Na+),故D正确。
故答案选D
【思路点拨】本题考查了溶液中的离子浓度关系,D选项一定要借助电荷守恒式进行解答。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
在新制的氯水中存在平衡:Cl2+H2O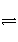
 H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.H+浓度减小,HClO浓度减小
B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大
D.H+浓度增大,HClO浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mo1·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B.c(NH4+) / c (NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,下列叙述正确的是
A.“碳纳米泡沫”与石墨互为同位素
B.把“碳纳米泡沫”分散到适当的溶剂中,能产生丁达尔现象
C.“碳纳米泡沫”是一种新型的碳化合物
D.“碳纳米泡沫”和金刚石的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是
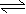
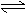 A.H2A在水溶液中的电离方程式为:H2A H++HA-,HA- H++A2-
A.H2A在水溶液中的电离方程式为:H2A H++HA-,HA- H++A2-
B.(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-)
C.0.0lmol·L-l的H2A溶液pH=2
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多
查看答案和解析>>
科目:高中化学 来源: 题型:
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积固定的容器中发生反应:COg)+2H2g)CH3OHg) ΔH<0,各物质的浓度如表所示:
| 浓度 时间 | cCO)/mol·L-1 | cH2)/mol·L-1 | cCH3OH)/mol·L-1 |
| 0 | 0.8 | 1.6 | 0 |
| 2 min | 0.6 | x | 0.2 |
| 4 min | 0.3 | 0.6 | 0.5 |
| 6 min | 0.3 | 0.6 | 0.5 |
下列说法不正确的是 )。
A.2~4 min内用H2表示的平均反应速率为0.3 mol·L-1·min-1
B.达到平衡时,CO的转化率为62.5%
C.反应在第2 min时改变了条件,可能是加入了催化剂
D.反应在第2 min时改变了条件,可能是增加了H2的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
图中是部分短周期元素原子半径与原子序数的关系图。则下列说法不正确的是双选) )。
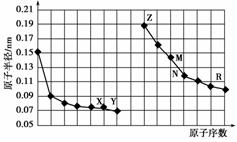
A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X>Z>M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质不能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃和1.01×105 Pa时,反应:2N2O5(g)===4NO2(g)+O2(g) ΔH=56.76 kJ·mol-1自发进行的原因是( )
A.是吸热反应
B.是放热反应
C.是熵减小的反应
D.熵增大效应大于能量效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com