
����Ŀ��ԭ��ؿɽ���ѧ��ת��Ϊ���ܣ�����������͵�ԭ��أ�̽��������ת��Ч�ʣ���ѡ���ϣ�ZnSO4��aq����CuSO4��aq����ͭƬ��пƬ�͵��ߣ�
��1�������ԭ��ؼ�װ��ʾ��ͼ����ͼ����������Ӧ��ע��Ҫ����ͬһ�ձ��У��缫����Һ����ͬ�Ľ���Ԫ���� 
����ͭƬΪ�缫֮һ��CuSO4��aq��Ϊ�������Һ��ֻ��һ���ձ�����װԭ����ң�����һ��ʱ��ɹ۲쵽���� ��
�ۼ�������ԭ����пɸ���Ч�ؽ���ѧ��ת��Ϊ���ܵ��� �� ��ԭ���� ��
����������CuSO4��Һ��Ǩ�Ƶ�������������ţ�
A��K+ B��NO3�� C��Ag+ D��SO42��
��2�����ԭ���ڻ�ѧ��ҵ�����Ź㷺��Ӧ�ã��ֽ�����Ƶ�ԭ���ͨ��������ͼ2�е������������У�aΪ���Һ��X��Y������缫�壬�� ����X��Y��Ϊ���Ե缫��aΪCuSO4��Һ������ʱ�Ļ�ѧ��Ӧ����ʽΪ �� ͨ��һ��ʱ�����������Һ�м���0.2molCuO��ĩ��ǡ�ûָ����ǰ��Ũ�Ⱥ�pH�����������ת�Ƶĵ��ӵ����ʵ���Ϊ ��
����X��Y�ֱ�Ϊ����ͭ��a��ΪCuSO4��Һ����Y���ĵ缫��ӦʽΪ ��
���𰸡�
��1�� ���缫���ܽ⣻�ף��ڼ�װ����,��������Cu2+�Ӵ�,������Cu2+ֱ���븺��������Ӧ��ʹ��ѧ��ת��Ϊ���ܣ� A
���缫���ܽ⣻�ף��ڼ�װ����,��������Cu2+�Ӵ�,������Cu2+ֱ���븺��������Ӧ��ʹ��ѧ��ת��Ϊ���ܣ� A
��2��2CuSO4+2H2O ![]() 2Cu+O2��+2H2SO4��0.4mol�� Cu��2e��=Cu2+
2Cu+O2��+2H2SO4��0.4mol�� Cu��2e��=Cu2+
���������⣺��1������ͬһ�ձ��У��缫����Һ����ͬ�Ľ���Ԫ�أ���ͼʾ���ԭ��أ�п��������ͭ��������ԭ��صļ�װ��ʾ��ͼΪ��  �����Դ��ǣ�
�����Դ��ǣ�  ��
��
����ͭƬΪ�缫֮һ��CuSO4��aq��Ϊ�������Һ��ֻ��һ���ձ�����װԭ����ң�����ԭ��ط�Ӧ��ԭ������Ҫѡ�ñ�ͭ���õ�п���������²�ԭ��أ���������������Ӧ��Zn��2e��=Zn2+��п�ܽ⣬���Դ��ǣ��缫���ܽ⣻
�ۼ�������ԭ����пɸ���Ч�ؽ���ѧ��ת��Ϊ���ܵ��Ǽף���Ϊ���Ա��ֵ����ȶ�����ѧ�ܻ�����ת��Ϊ���ܣ������еĻ��ý�����������CuSO4��Һ�����û���Ӧ����������ת��Ϊ���ܣ�
���Դ��ǣ��ף����Ա��ֵ����ȶ�����ѧ�ܻ�����ת��Ϊ���ܣ������еĻ��ý�����������CuSO4��Һ�����û���Ӧ����������ת��Ϊ���ܣ�
��������������������Ǩ�ƣ���������Ǩ�ƣ�������������CuSO4��Һ��Ǩ�Ƶ������Ǽ����ӣ���ѡA����2���ٵ������ͭ��Һʱ����������������������������ͭ��ͬʱ��Һ���������ᣬ���ԣ������缫��ӦΪ��4OH����4e��=H2O+O2������ط�ӦʽΪ��2CuSO4+2H2O ![]() 2Cu+O2��+2H2SO4������ͭԭ���غ�֪������ͭ��ͭ�ı���1��1������0.2molCuO������0.2molͭ��ת�Ƶ��ӵ����ʵ���=0.2mol��2=0.4mol��
2Cu+O2��+2H2SO4������ͭԭ���غ�֪������ͭ��ͭ�ı���1��1������0.2molCuO������0.2molͭ��ת�Ƶ��ӵ����ʵ���=0.2mol��2=0.4mol��
���Դ��ǣ�2CuSO4+2H2O ![]() 2Cu+O2��+2H2SO4��0.4mol��
2Cu+O2��+2H2SO4��0.4mol��
����X��Y����Ϊ����ͭ��a��ΪCuSO4��Һ���ж�X������YΪ����������ͭʧ��������ͭ���ӣ�Y���缫��ӦΪCu��2e��=Cu2+��
���Դ��ǣ�Cu��2e��=Cu2+��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Щ���ʵ�����в������Ƿ��ӣ� ��
A. DNA B. ��ά�� C. ATP D. ���̴�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з�Ӧ�У���Ԫ�ر��ֳ������Ե��ǣ� ��
A.ϡ������п��ӦB.����������������Ӧ
C.Ũ������ͭ��ӦD.����������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ�������
A.��ϡ��ˮ��μ���ϡ�����У�����Һ��pH=7ʱ��c��SO42������c��NH4+��
B.NaHCO3��Һ�У�c ��CO32����+c��H+��=c��H2CO3��+c��OH����
C.1 L 0��1 molL��1CuSO4��NH4��2SO46H2O��Һ�У�c��SO42������c��NH4+����c��Cu2+����c��H+����c��OH����
D.��0.1mol/L�İ�ˮ�м�����������粒��壬����Һ��c��OH����/c��NH3H2O������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1-������������Ũ���������£�ͨ��������Ӧ�Ƶ����ᶡ������Ӧ�¶�Ϊ115��125�棬��Ӧװ����ͼ�����жԸ�ʵ��������������
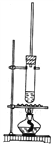
A. ������ˮԡ����
B. ����������������������
C. Ϊ�ᴿ���ᶡ��������ˮ��̼������Һϴ��
D. ͨ���������1-��������������ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� Cu/ZnO���������£�CO2��H2�ɷ������з�Ӧ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g��
��1����Ӧ�б�������Ԫ���ǣ�____����������____���������з���ʽ���õ����ű������ת�Ƶķ������Ŀ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g��____
CH3OH��g��+H2O��g��____
��2���÷�Ӧ��ƽ�ⳣ������ʽ K=____����ֻ����CO2��Ũ�ȣ���ƽ����____�ƶ���ƽ�ⳣ�� K___��ѡ�������С�����䡱����
��3������ͼ���Կ����������¶Ȳ�ͬ��A��B��___�ȴﵽƽ��״̬��˵����Ӧ�¶� A___B��ѡ���������������=�������Ӽ״���������ıȽϻ�����˵���÷�Ӧ��______�ȷ�Ӧ��ѡ��š�������������Ӧ���е�ͼ��M��ʱ������Ӧ����______�淴Ӧ���ʣ�ѡ������� ��������=������

��4��һ�������£��� n(CO2):n(H2)=1:1 �Ļ����������º����ܱ������У�������������______��ѡ��ܶȡ���ѹǿ�������ֲ��䣬˵���÷�Ӧ�Ѵ�ƽ��״̬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����:Ksp(PbI2)=4��10-6��Ksp(PbS)=8��10-28��ȡ������ɫPbI2�������Ƴ�100mL��Һ�����ƹ�������Һ������Ũ����ʱ��ı仯��ϵ��ͼ��ʾ������˵������ȷ����

A. A�㴦�ɱ�ʾPbI2�IJ�������Һ
B. Tʱ���п������PbI2��Һ�м�����KI����
C. ������PbI2������Һ�е�c(I-)=10-2mol/L
D. ��A�㴦��PbI2��Һ�м���100mL 2��10-3mol/L��Na2S��Һ,ƽ�����Һ�е�c(Pb2+)<4��10-3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������˵����ȷ����
A. ԭ��ؽ���ѧ��ת��Ϊ����
B. ԭ��ؽ�����ת��Ϊ��ѧ��
C. �кͷ�Ӧ����˵���кͷ�Ӧǰ���������غ�
D. ���ȷ�Ӧ������������������ڷ�Ӧ���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com