
| A. | NaCl固体中含有共价键 | |
| B. | CO2分子中含有离子键 | |
| C. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C是碳的三种核素 | |
| D. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同的中子数 |
分析 A.NaCl为离子化合物,只含有离子键;
B.CO2为共价化合物;
C.为相同元素,但质量数不同;
D.根据质量数=质子数+中子数判断.
解答 解:A.NaCl只含有离子键,不含共价键,故A错误;
B.CO2为共价化合物,不含离子键,故B错误;
C.${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C为相同元素,但质量数不同,属于不同核素,故C正确;
D.${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同质子数,但质量数不同,则中子数分别为8、9、10,故D错误.
故选C.
点评 本题考查较为综合,涉及共价键、离子键、核素以及原子构成等知识,为高频考点,侧重于基本概念的理解和运用的考查,注意把握离子键和共价键的区别,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 该氧化物是含有非极性键的离子化合物 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该晶体晶胞结构与CsCl相似 | |
| D. | 晶体中Ba2+的配位数为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | AlN的摩尔质量为41 g | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | 上述反应中,每生成1 mol AlN需转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
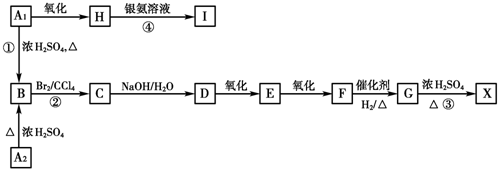
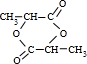 .
.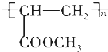 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
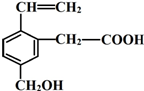 某有机物的结构简式如图,该物质可能有的化学性质是( )
某有机物的结构简式如图,该物质可能有的化学性质是( )| A. | ①②③⑥ | B. | ①②④⑤ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com