
分析 发生NaOH+HCl=NaCl+H2O,n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,结合反应及c=$\frac{n}{V}$计算.
解答 解:(1)n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,答:氢氧化钠的物质的量为0.1mol;
(2)由NaOH+HCl=NaCl+H2O可知,n(HCl)=n(NaOH)=0.1mol,其浓度为$\frac{0.1mol}{0.1L}$=1mol/L,答:盐酸的物质的量浓度为1mol/L.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意物质的量的基本计算公式的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白精的主要成分是次氯酸钙 | B. | 漂白精露置在空气中会失效 | ||
| C. | 漂白精水溶液具有漂白性 | D. | 漂白精杀菌效果随pH降低而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
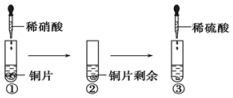
| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ②中溶液存在:c(Cu2+)+c(H+)=c(NO3-)+c(OH-) | |
| C. | 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应 | |
| D. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
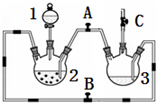 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
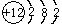 ;
;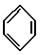 ,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com