
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
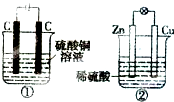 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积:①=② |
| B、溶液的pH变化:①减小,②增大 |
| C、电极反应式:①中阳极为4 OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑ |
| D、①中阴极质量增加,②中正极质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| c(Br-) |
| c(Cl-) |
| c(Br-) |
| c(Cl-) |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图两个装置中用滴有酚酞的NaCl溶液做电解质溶液,进行化学能和电能相互转化的研究.请回答:
如图两个装置中用滴有酚酞的NaCl溶液做电解质溶液,进行化学能和电能相互转化的研究.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| B、等物质的量浓度、等体积的Na2S与KHSO3溶液混合c (Na+)>c(K+)>c(SO32-)>c(HS-)>c(OH-)>c((H+) |
| C、在0.1mol?L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) |
| D、pH<7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2c(A2-)═c(OH-)+c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 除去Cl2中的HCl杂质 |
B、 稀释浓硫酸 |
C、 检查装置气密性 |
D、 实验室制取NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com