
【题目】将铜片和锌片用导线连接并插入稀硫酸中,锌片的表面有少量气泡产生并逐渐溶解变薄。铜片没有溶解现象,但表面出现大量气泡,经检测上述气体的成分均为H2。在导线上检测到有持续的电流产生。基于上述现象,下列推测不合理的是( )

A.负极(锌片)区域只发生了氧化反应
B.H+还原所需的电子均由Zn提供
C.电子从锌经导线迁移向铜而产生电流
D.生成的H2由溶液中H+还原得到
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】以下离子方程式书写正确的是
A.用醋酸除去水垢:2H+ + CaCO3 = Ca2++CO2↑+H2O
B.向NH4HCO3溶液中加入足量石灰水:Ca2+ + HCO3-+OH-= CaCO3↓ + H2O
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3 ↓
=Al2(CO3)3 ↓
D.侯氏制碱法中NaHCO3的制备:Na+ + NH3 + CO2 + H2O = NaHCO3 ↓ + NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是( )
A.均减半B.均加倍C.均增加1molD.均减少1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)![]() N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:
N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:

下列说法正确的是
A.组别①中0 ~20 min内,NO2降解速率为0.0125molL-1min-1
B.由实验数据可知温度T1<T2
C.40min时,表格中M对应的数据为0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
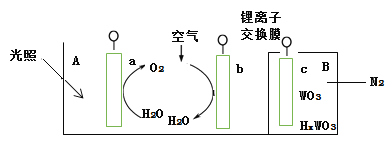
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.用排饱和食盐水的方法收集氯气
B.500℃左右比室温更有利于工业合成NH3的反应
C.加入催化剂有利于SO2的氧化反应
D.对2HI(g)![]() H2(g) + I2(g),减小容器体积,气体颜色变深
H2(g) + I2(g),减小容器体积,气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pNi=-lgc(Ni2+);常温下,K(NiCO3)=1.4×10-7,H2S的电离平衡常数:Ka1=1.3×10-7,Ka2=7.1×10-15。常温下,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法不正确的是( )。
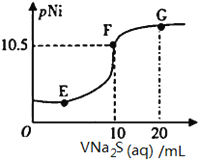
A. E、F、G三点中,F点对应溶液中水电离程度最小
B. 常温下,Ksp(NiS)=1×10-21
C. 在NiS和NiCO3的浊液中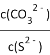 =1.4×1014
=1.4×1014
D. Na2S溶液中,S2-第一步水解常数Kh1=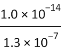
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究酸雨对低碳钢腐蚀的影响,实验流程如图:

实验使用了3种模拟酸雨。模拟酸雨中的离子浓度如表所示,其中平衡电荷的阳离子以NH![]() 或Na+补充,实验均在室温下进行,低碳钢片样品的大小和质量均相同。
或Na+补充,实验均在室温下进行,低碳钢片样品的大小和质量均相同。

(1)将模拟酸雨1和模拟酸雨2进行对比实验,实验的目的是___。模拟酸雨3对钢片的腐蚀速率大于模拟酸雨2对钢片的腐蚀速率,可以得到结论是___。
(2)在用模拟酸雨2进行实验时,腐蚀冲洗液中检测到Fe2+和NH![]() 的含量升高。腐蚀时硝酸和铁反应的离子方程式为___。
的含量升高。腐蚀时硝酸和铁反应的离子方程式为___。
(3)在上述三组腐蚀实验中,都检测到钢片内部持续产生腐蚀电流。产生腐蚀电流的原因是___。
(4)钢铁的腐蚀研究中,通常用“腐蚀速率(单位为mg·h-1)"对钢铁腐蚀过程和结果进行评估。则计算“腐蚀速率”需要测量的实验数据为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 平衡常数为K2
FeO(s)+H2(g) ΔH2 平衡常数为K2
不同温度下,K1、K2的值如下表:
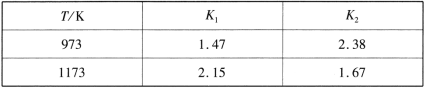
现有反应Ⅲ:H2(g)+CO2(g) ![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:
2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0。
C2H5OH(g)+3H2O(g) H<0。
设m为起始时的投料比,即m= n(H2)/ n(CO2)。
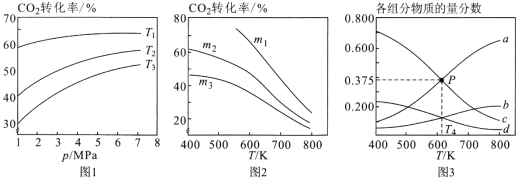
①图1中投料比相同,温度从高到低的顺序为______________________。
②图2中m1、m2、m3从大到小的顺序为________________________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为______________,T4温度时,该反应平衡常数KP的计算式为(不必化简)_______________________。
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH___________7(填“>”、“=”或“<”)。烟气需冷却至15.5℃~26.5℃的可能原因是____________。
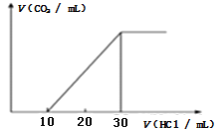
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com