

分析 (1)根据废水pH与Cr2O72-转化为Cr3+的关系图1分析;
(2)①阴极,根据放电顺序阴极上是电解质中氢离子得电子的反应;
②在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,据此书写离子方程式;
解答 解:(1)根据废水pH与Cr2O72-转化为Cr3+的关系图1可知:当pH为1时,Cr2O72-转化为Cr3+的转化率接近100%,
故答案为:调节pH为1左右;
(2)①阴极,根据放电顺序阴极上是电解质中氢离子得电子的反应,即2H++2e=H2↑,故答案为:2H++2e-═H2↑;
②在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
点评 本题考查氧化还原反应、电解原理等,需要学生具备扎实的基础知识,平时注意培养分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 便于形成规则的几何外形 | |
| B. | 微观微粒结合得越紧密,体系总能量越低,体系越稳定 | |
| C. | 便于使晶体具有对称性 | |
| D. | 为了使晶体具备各向异性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 1H和2H是不同的核素,它们的质子数相等 | |
| C. | ${\;}_{90}^{230}$Th与${\;}_{90}^{232}$Th互为同素异形体 | |
| D. | ${\;}_{1}^{1}$ H、${\;}_{1}^{2}$ H、${\;}_{1}^{3}$ H、H+、H2是氢元素的五种不同粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、I-、Na+能在该溶液中大量共存 | |
| B. | 通入H2S气体,发生反应的离子方程式为:H2S+Fe2+═FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | 和少量的NaOH溶液充分反应并加热,可生成标准状况下的NH3 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
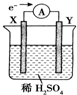 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中,SO42-朝Y极移动 | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①中正极附近溶液pH减小 | |
| B. | 图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 | |
| C. | 图②正极反应是O2+2H2O+4e-═4OH- | |
| D. | 图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
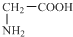

| A. | 全部 | B. | ①②④⑤⑥ | C. | ②③④⑤⑥ | D. | ②④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com