
 .(不考虑空间构型)
.(不考虑空间构型) 分析 (1)Cr原子核外有24个电子,根据构造原理书写其核外电子排布式;
(2)单键都为σ键,双键中有1个σ键;
(3)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;
(4)氢键的存在导致物质的熔沸点升高,乙醇分子间存在氢键,而乙醛分子间不存在氢键;
(5)原子个数及价电子数相等的微粒是等电子体;
(6)[Cr(OH)4]2-中是Cr3+与4个OH-形成配位键.
解答 解:(1)Cr原子核外有24个电子,根据构造原理知其核外电子排布式为:[Ar]3d54s1或1s22s22p63s23p63d54s1,
故答案为:[Ar]3d54s1或1s22s22p63s23p63d54s1;
(2)CH3COOH分子中含有3个碳氢键、1个碳碳键、2个碳氧键和1个氧氢键;1mol乙酸分子含有6molσ键,
故答案为:6;
(3)乙醛(CH3CHO)中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型,
故答案为:sp2,sp3;
(4)氢键的作用力大于范德华力,则分子间形成氢键的沸点较高,C2H5OH分子间存在氢键,而CH3CHO分子间不能形成氢键,所以乙醇的沸点比乙醛的高,
故答案为:乙醇分子间存在氢键,而乙醛分子间不存在氢键;
(5)SO42-中含有5个原子,其价电子数是32,与SO42-互为等电子体的阴离子为:PO43-、SiO44-,
故答案为:PO43-或SiO44-;
(6)[Cr(OH)4]2-中的Cr2+与4个OH-形成配位键,可表示为 ,
,
故答案为: .
.
点评 本题综合考查物质的结构与性质知识,侧重于电子排布式、σ键、杂化类型、氢键、等电子体与配位键等知识,题目难度中等,注意把握杂化类型的判断方法.


科目:高中化学 来源: 题型:选择题
| A. | Na、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | NH4+、K+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
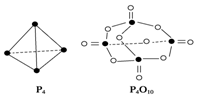 白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6b+5d-4c-12a) kJ•mol-1 | B. | (4b+5d-4c-12a) kJ•mol-1 | ||
| C. | (4c+12a-4b-5d) kJ•mol-1 | D. | (4c+12a-6b-5d) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200g63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1 盐酸和足量MnO2共热,转移的电子数目为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标况下)气体时,电路中通过的电子数目为4NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
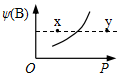 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 2 L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com