
| A、S2- |
| B、NH4+ |
| C、CO32- |
| D、HCO3- |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、②④⑥ |
| C、③④⑤ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
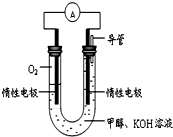 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C5H9NO |
| B、C5H9NO2 |
| C、C5H9NO3 |
| D、C5H9NO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的化学式为CuS,它既是氧化产物又是还原产物 |
| B、5 mol FeS2发生反应,有10 mol电子转移 |
| C、产物中的SO42-离子有一部分是氧化产物 |
| D、FeS2只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该分散系能产生丁达尔效应 |
| B、该分散质颗粒能透过滤纸 |
| C、该分散质颗粒能透过半透膜 |
| D、该分散质颗粒能发生布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙烯水化:CH2=CH2+H2O
| |||
B、葡萄糖发酵:C6H12O6
| |||
C、溴乙烷水解:CH3CH2Br+H2O
| |||
D、丙酸乙酯水解:CH3CH2COOCH2CH3+H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com