
 O2
O2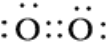 NH4+
NH4+ Na2O2
Na2O2
 CH4:
CH4: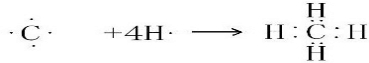 .
. 分析 (1)MgCl2是离子化合物含有离子键,镁离子与2个氯离子通过离子键结合;
氧气中两个氧原子通过共用电子对结合;
氨根离子为阳离子,氮原子与氢原子间通过共价键结合,注意用中括号;
过氧化钠中两个氧原子通过共用电子对结合,两个钠离子与过氧根离子通过离子键结合;
(2)二氧化碳为共价化合物,碳原子与两个氧原子分别共用2对电子;
甲烷为共价化合物,碳原子与4个氢原子分别共用1对电子.
解答 解:(1)MgCl2是镁离子与2个氯离子通过离子键结合,电子式为: ;
;
氧气中两个氧原子通过共用电子对结合,电子式为: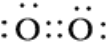 ;
;
氨根离子为阳离子,氮原子与氢原子间通过共价键,电子式为: ;
;
过氧化钠为离子化合物,2个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用电子对结合,电子式为: ;
;
故答案为: ;
;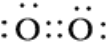 ;
;
 ;
;
(2)二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为: ,
,
甲烷为共价化合物,用电子式表示甲烷的形成过程为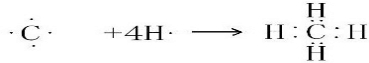 ,
,
故答案为: ;
;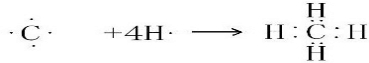 .
.
点评 本题考查了电子式的书写和用电子式表示常见物质的形成过程,明确物质的结构、形成化学键的类型是解题关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中a=-160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 不纯物质 | 处杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙醇(水) | 新制生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量呈周期性变化 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com