
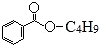
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | X难溶于水 | B. | X的分子式为C11H14O2 | ||
| C. | 组成为-C4H9的烃基有3种 | D. | X能发生加成反应、取代反应 |
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结论 |
| A | 无色溶液变蓝 | I-在酸性条件下被氧气氧化为I2 |
| B | 溶液均呈红色,且深浅一样 | 相同浓度的CO32-与HCO3-水解能力相同 |
| C | 产生白色沉淀又逐渐变成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 溴的四氯化碳溶液颜色褪去 | 石蜡催化加热反应产物为乙烯 |
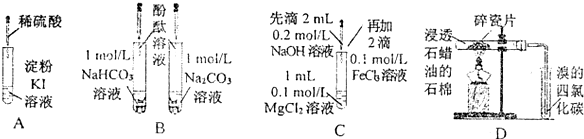
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的水解 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
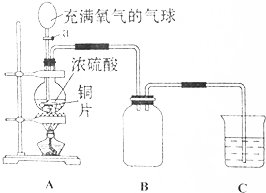 小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.
小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全燃烧生成二氧化碳和水的化合物不一定是烃 | |
| B. | 相同质量的正丁烷和异丁烷分别完全燃烧,耗氧量相等 | |
| C. | 相同物质的量乙烯和乙醇分别完全燃烧,耗氧量相等 | |
| D. | 相同质量的乙烷和乙炔分别完全燃烧,耗氧量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com