
(7分) 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
(3)根据下图操作及现象推断酸X为_______(填序号)。
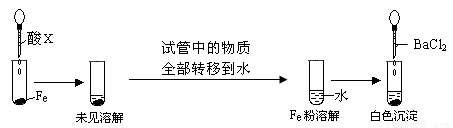
a.浓盐酸 b.浓硫酸 c.浓硝酸
(7分)(1) Cu+H2O2+2HCl == CuCl2+2H2O(2分)
(2)大于(1分);3Cu+8H++2NO3— == 3Cu2++2NO↑+4H2O(2分)
(3)b(2分)
【解析】
试题分析:(1)在氧化剂过氧化氢的作用下把铜氧化成了铜离子,过氧化氢被还原为水,故方程式为: Cu+H2O2+2HCl == CuCl2+2H2O;(2)铜只与浓硫酸反应,与稀硫酸不反应,故被还原的硫酸为0.9mol,反应掉的硫酸为1.8mol,反应后的溶液中还存在硫酸,故反应前硫酸的物质的量大于1.8mol,溶液的体积大于100ml;溶液中有氢离子,加入硝酸盐提供硝酸根离子,氢离子和硝酸根离子把铜氧化,故方程式为:3Cu+8H++2NO3— == 3Cu2++2NO↑+4H2O(2分);(3)铁和浓盐酸反应,排除a;铁放入浓硫酸、浓硝酸中,常温下钝化,把试管中的物质转移到水中,把浓硫酸稀释,铁粉和稀的硫酸反应生成硫酸亚铁,加入氯化钡生成硫酸钡沉淀,而铁和稀的硝酸反应生成硝酸铁,加氯化钡不反应;故选B。
考点:铜和浓硫酸的反应、铁和浓硫酸、浓硝酸的反应、铜和硝酸的反应等知识。


科目:高中化学 来源:2013-2014江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关叙述正确的是( )
A.在一定条件下,反应CO(g)+2H2(g)  CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变
CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变
B.常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+ c(CH3COOH)=0.01mol/L
C.pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>①
D.已知某温度下:Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)= 1×10-12,,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L K2CrO4溶液,则先产生Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )
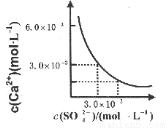
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:选择题
如图所示装置中,a?b都是惰性电极,通电一段时间后(电解液足量),a极附近溶液显红色?下列说法正确的是

A.a是负极,b是正极
B.CuSO4溶液的pH逐渐减小
C.铜电极上的反应式为
D.向NaCl溶液中加入一定量的盐酸,能使溶液与原来溶液完全一样
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:选择题
设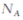 为阿伏加德罗常数的数值,下列说法正确的是
为阿伏加德罗常数的数值,下列说法正确的是
A.标准状况,1molSO3含O原子个数为3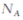
B.1.12LN2中含N2分子数为0.05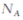
C.5.6gFe与足量稀盐酸反应,转移的电子数为0.3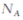
D.常温下pH=1的H2SO4溶液中,H+的个数为0.1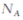
查看答案和解析>>
科目:高中化学 来源:2013-2014江西八一中学、洪都中学下学期期中考试高一化学试卷(解析版) 题型:选择题
下列说法正确的是
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014江西八一中学、洪都中学下学期期中考试高一化学试卷(解析版) 题型:选择题
有关氨的说法不正确的是
A.NH3是4核10电子的分子,三角锥形,具有还原性
B.NH3极易溶于水,可做喷泉实验;氨气易液化,液氨可用作制冷剂
C.氨气是非电解质,氨水是电解质
D.蘸有浓盐酸的玻璃棒遇氨气可产生白烟
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高二下学期期终考试化学试卷(解析版) 题型:选择题
对羟基苯甲醛(结构简式如图)是医药工业和香料工业的重要中间体。下列说法不正确的是

A.能发生水解反应
B.有两种含氧官能团
C.与苯甲酸(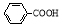 )互为同分异构体
)互为同分异构体
D.一定条件下能与溴水、FeCl3溶液及银氨溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:实验题
(20分)某研究性学习小组在实验室中配制0.20mol·L-1的盐酸标准溶液,然后用其滴定某未知浓度的氢氧化钠溶液。
⑴配制待测液:将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要玻璃仪器除烧杯,200 mL容量瓶,量筒,还有 ﹑ 。
⑵滴定:
①盛装0.20mol·L-1盐酸标准液应该用 式滴定管,
②滴定时,先向锥型瓶中加酚酞作为指示剂;再逐滴滴定,观察到 时为滴定终点。
③有关数据记录如下:
滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
起始读数 滴定前 | 终点读数 | ||
1 | 20.00 | 0.50 | 20.40 |
2 | 20.00 | 6.00 | 26.10 |
3 | 20.00 | 4.00 | 24.00 |
数据处理:NaOH溶液的浓度为 mol·L-1,烧碱样品的纯度为 。(保留三位有效数字)
⑶试分析以下各项操作对实验结果的可能影响,用“偏高”﹑“偏低”或“无影响”等填空:
①若用蒸馏水冲洗锥形瓶,则会使测定的结果 ;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果 ;
④读数时,若滴定前俯视读数,滴定后仰视读数,则会使测定结果 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com