
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B. 晶体中与每个K+距离最近的K+有8个
C. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D. 晶体中,0价氧与﹣2价氧的数目比为2:1
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(s)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A. v(A)=0.5 mol·L-1·s-1 B. v(B)=0.5 mol·L-1·s-1
C. v(C)=0.9mol·L-1·s-1 D. v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下, HNO2的电离平衡常数为K=4.6×10-4(已知![]() , 向20ml 0.01mol.L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
, 向20ml 0.01mol.L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )

A. X=20
B. a、b、c、d四点对应的溶液中水的电离程度逐渐减小
C. a点的溶液中c(H+)=2.14×10-3mol·L-1
D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>(NO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个氯气分子的物质的量是________,氯原子的物质的量是________。
(2)1.5mol Na2SO4·10H2O中所含的Na+的物质的量是________,所含的SO42-的物质的量是________,所含H2O的数目是______。
(3)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为______。
(4)0.5mol NaOH中含有电子的物质的量是__________,在________mol Na2CO3中所含Na+数目与上述0.5mol NaOH所含Na+数目相等。
(5)12.4g Na2R含0.4mol Na+,则Na2R的摩尔质量为_______,R的相对原子质量为________。含R的质量为1.6g的Na2R,其物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 某外围电子排布为4d15s2基态原子,该元素位于周期表中第五周期第ⅢB族
B. 在元素周期表中,s区,d区和ds区的元素都是金属元素
C. 当碳原子的核外电子排布由![]() 转变为
转变为![]() 时,释放能量,由激发态转化成基态
时,释放能量,由激发态转化成基态
D. 非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3高,原因是________________________________________________。
(2)Na3AsO4 中含有的化学键类型包括________________________;AsO43-的空间构型为____________(用文字描述)。
(3)NH3和F2在Cu催化下可发生反应4NH3+3F2=NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____________________(填序号)。写出基态铜原子的价电子排布式_______________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表法、图象法是常用的科学研究方法。
(1)短周期某主族元素M的电离能情况如图1所示。则M元素位于周期表的第_____族。
(2)图2是研究部分主族元素氢化物的沸点变化规律的图象,折线c可以表达出第_____族元素气态氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线(a和b),你认为正确的是折线_____(填a或b)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以方潜矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示:

部分化合物的Ksp如下表所示:
物质 | PbCl2 | PbS | PbCrO4 |
Ksp | 1.2×10-5 | 9.0×10-29 | 1.8×10-14 |
请回答下列问题:
(1)“焙烧”生成的气体可用于工业制备____________。
(2)写出“高温还原”的主要化学方程式:____________。
(3)“粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时阴极反应式为____________。阳极泥的主要成分为____________。
(4)铅与稀盐酸反应产生少量气泡后反应终止,原因是____________。写出制备PbO2的离子方程式:____________。
(5)Pb(NO3)2是强酸弱碱盐,氢硫酸(H2S)是弱酸,向Pb(NO3)2溶液中通入H2S气体是否能产生黑色PbS沉淀____________?(列式计算说明,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15)。
(6)将PbCrO4加入足量硝酸中,部分振荡,观察到主要现象是____________,反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如下图所示(Ea表示活化能),下列说法不正确的是
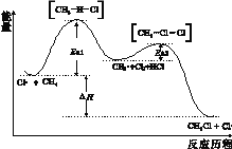
A. 已知Cl·是由Cl2在光照条件下化学键断裂生成的,该过程可表示为:![]()
B. 相同条件下,Ea越大反应速率越慢
C. 图中ΔH<0,其大小与Ea1、Ea2无关
D. CH4转化为CH3Cl的过程中,所有C-H发生了断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com