
【题目】下列关于有机物的说法正确的是
A.乙醇和丙三醇互为同系物
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D.桥环烃二环[2,2,0](![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
【答案】C
【解析】
A项、同系物必须是同类物质,含有相同数目的相同官能团,乙醇和丙三醇含有的羟基数目不同,不互为同系物,故A错误;
B项、环己烯分子中1个含碳碳双键,但4个亚甲基均为饱和碳原子,分子中含有饱和碳原子,所有碳原子不可能共面,故B错误;
C项、分子式为C5H10O2属于酯的同分异构体可能为以下几种情况:若为甲酸和丁醇酯化,形成的酯有HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3共4种;若为乙酸和丙醇酯化,形成的酯有CH3COOCH2CH2CH3、CH3COOCH(CH3)2共2种;若为丙酸和乙醇酯化,形成的酯只有CH3CH2COOCH2CH31种;若为丁酸和甲醇酯化,形成的酯有CH3CH2CH2COOCH3、(CH3)2CHCOOCH3有2种,合计有9种,故C正确;
D项、桥环烃二环分子结构对称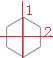 ,分子中含有2类氢原子,则一氯代物有2种,一氯代物
,分子中含有2类氢原子,则一氯代物有2种,一氯代物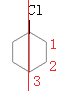 分子中含有3类氢原子,形成的二氯代物有3种,一氯代物
分子中含有3类氢原子,形成的二氯代物有3种,一氯代物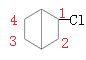 分子中含有4类氢原子,形成的二氯代物有4种,则二氯代物共有7种,故D错误;
分子中含有4类氢原子,形成的二氯代物有4种,则二氯代物共有7种,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】![]() 表示阿伏加德罗常数的值,工业制备硝酸的过程中发生反应
表示阿伏加德罗常数的值,工业制备硝酸的过程中发生反应![]() 。下列说法正确的是
。下列说法正确的是
A.室温下,22.4LNO2中所含原子总数为![]()
B.36g![]() 中含有
中含有![]() 键的总数为
键的总数为![]()
C.标准状况下,11.2LNO中所含电子总数为![]()
D.上述反应中,生成1mol![]() 转移电子的数目为
转移电子的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡1.8倍,下列叙述正确的是
A.平衡向正反应方向移动B.A的转化率变大
C.D的物质的量变多D.a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1.0L0.1mol·L-1乙酸钠溶液中,CH3COO-数目为0.1NA
B.11.2L(标准状况)正戊烷完全燃烧生成CO2分子的数目为2.5NA
C.标准状况下,14g乙烯与2-丁烯的混合物中含有的氢原子数为2NA
D.含0.1molHNO3的稀硝酸与足量Cu反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物说法不正确的是
A. 命名为2-乙基-1,3-二丁烯
命名为2-乙基-1,3-二丁烯
B.沸点比较:乙二醇>乙醇>乙烷
C.含8个碳原子的有机物的分子中可能形成8个C—C单键
D. 属于芳香烃且属于苯的同系物
属于芳香烃且属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1和图2是A、B两种物质的核磁共振氢谱。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( )
图1 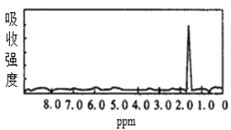 图2
图2 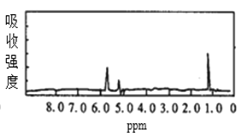
A.A是C3H6、B是C2H6B.A是C6H6、B是C4H6
C.A是C6H6、B是C2H6D.A是C3H8、B是C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示溶液中浓度的方法通常有两种:溶液中溶质的质量分数(w)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法,请完成填空。
(1)用10%(密度为1.01 g·cm-3)的氢氧化钠溶液配制成27.5 g 2% 的氢氧化钠溶液。
①计算:需________g 10%(密度为1.01 g·cm3)的氢氧化钠溶液,其体积为________mL,需加________mL水(ρ水=1 g·cm-3)进行稀释。
②量取:用________mL量筒取10% 氢氧化钠,量取时视线要跟量筒________保持水平,然后倒入烧杯里,用________mL量筒量取蒸馏水也注入烧杯里。
③溶解:用________将上述溶液搅拌均匀,即得27.5 g 2% 的氢氧化钠溶液。
(2)用98%(密度为1.84 g·cm-3)的浓硫酸稀释成3 mol·L-1的稀硫酸100 mL,回答下列问题:
①需要取浓硫酸________mL;
②配制操作可分解成如下几步,以下正确的操作顺序是__________________________(填字母,下同)。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度线相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)实验室需配制1 mol·L-1的氢氧化钠溶液和1 mol·L-1的硫酸溶液各100mL。
①要配制氢氧化钠溶液,在用托盘天平称取氢氧化钠固体时,天平读数为________。
A.4.0 g B.4.00 g C.>4.0 g
②在配制氢氧化钠溶液和硫酸溶液的各步操作中,有明显不同的是__________。
A.称量或量取 B.溶解或稀释 C.移液、洗涤 D.定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用真空碳热还原冶炼镁、铝及锰的单质或合金是治金工业的热点之一。回答下列问题:
(1)已知体系自由能变化![]() 时反应能自发进行。
时反应能自发进行。![]() 真空碳热还原冶炼镁的主要反应为
真空碳热还原冶炼镁的主要反应为![]() ,其自由能变化与温度、压强的关系如图所示:
,其自由能变化与温度、压强的关系如图所示:

温度由低到高的顺序是_______________,![]() 时该反应不能自发进行的温度是_________(填“
时该反应不能自发进行的温度是_________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 提出的碳热还原
提出的碳热还原![]() 冶炼
冶炼![]() 的机理如下:
的机理如下:
(Ⅰ)![]()
(Ⅱ)![]()
(Ⅲ)![]()
则反应![]() 的
的![]() ______________
______________![]() (用含a、b、c的代数式表示);中间体之一
(用含a、b、c的代数式表示);中间体之一![]() 与
与![]() 反应可用于实验室制备甲烷,写出
反应可用于实验室制备甲烷,写出![]() 与
与![]() 反应的化学方程式:_________________________________________________________。
反应的化学方程式:_________________________________________________________。
(3)制备锰合金的相关反应及平衡时![]() 与温度的关系如图所示(
与温度的关系如图所示(![]() 为用分压表示的平衡常数,分压=总压×体积分数):
为用分压表示的平衡常数,分压=总压×体积分数):
(Ⅰ)![]()
(Ⅱ)![]()
(Ⅲ)![]()
①![]() 的反应是___________(填标号)。
的反应是___________(填标号)。
②![]() ____________[用
____________[用![]() 、
、![]() 表示];A点
表示];A点![]() ___________用[
___________用[![]() 表示]。
表示]。
③向某恒容密闭容器中充入![]() 并加入足量
并加入足量![]() ,若只发生反应:
,若只发生反应:![]() ,达到B点的平衡状态。达到平衡前,v(正)__________v(逆)(填“大于”“小于”或“等于”),达到平衡时,
,达到B点的平衡状态。达到平衡前,v(正)__________v(逆)(填“大于”“小于”或“等于”),达到平衡时,![]() _______________(保留小数点后两位)。
_______________(保留小数点后两位)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收![]() 溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
![]()
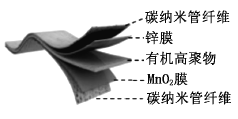
下列说法中,正确的是( )
A.充电时,![]() 移向Zn膜
移向Zn膜
B.充电时,含有![]() 膜的碳纳米管纤维一端连接有机高聚物电源负极
膜的碳纳米管纤维一端连接有机高聚物电源负极
C.放电时,电子由锌膜表面经有机高聚物至![]() 膜表面
膜表面
D.放电时,电池的负极反应为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com