
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
 .
.分析 I.(1)由表格中数据可知,0~2min内HI减少1.80mol-1.64mol=0.16mol,由2HI(g)?H2(g)+I2(g),可知生成氢气为0.08mol,结合v=$\frac{△c}{△t}$计算;
(2)结合平衡的特征”等、定“及衍生的物理量判定平衡;
II.(3)乙醇与乙酸反应生成乙酸乙酯和水,为酯化反应,属于取代反应;
(4)葡萄糖含-CHO,能被新制Cu(OH)2悬浊液氧化;
(5)乙烯通入溴的四氯化碳溶液中,发生加成反应生成1,2-二溴乙烷;乙烯在一定条件下发生加聚反应生成聚乙烯,聚乙烯中不含双键;
(6)苯为平面结构,不含双键,不能与溴水发生加成反应.
解答 解:I.(1)由表格中数据可知,0~2min内HI减少1.80mol-1.64mol=0.16mol,由2HI(g)?H2(g)+I2(g),可知生成氢气为0.08mol,则用H2表示0~2min内该反应的平均速率v(H2)=$\frac{\frac{0.08mol}{2L}}{2min}$=0.02mol•L-1•min-1,故答案为:0.02mol•L-1•min-1;
(2)A.正、逆反应速率相等,达到平衡状态,故A不选;
B.c(HI):c(H2):c(I2)=2:1:1,与起始量、转化率有关,不能判定平衡状态,故B选;
C.该反应为反应前后气体物质的量不变的反应,则反应容器内气体的总物质的量始终不随时间变化,不能判定平衡状态,故C选;
故答案为:BC;
II.(3)乙醇与乙酸反应生成乙酸乙酯和水,为酯化反应,属于取代反应,反应为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;取代反应(或酯化反应);
(4)葡萄糖含-CHO,能被新制Cu(OH)2悬浊液氧化,则检验葡萄糖常用新制Cu(OH)2悬浊液,将二者混合共热,观察到现象为生成砖红色沉淀(或红色沉淀),
故答案为:生成砖红色沉淀(或红色沉淀);
(5)乙烯通入溴的四氯化碳溶液中,发生加成反应生成1,2-二溴乙烷,反应为CH2=CH2+Br2→CH2BrCH2Br;乙烯在一定条件下发生加聚反应生成聚乙烯,聚乙烯中不含双键,聚乙烯的结构简式为 ,
,
故答案为:CH2=CH2+Br2→CH2BrCH2Br; ;
;
(6)A.苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键,不存在单双键的交替结构,故A正确;
B.苯分子里的6个碳原子和6个氢原子在同一个平面上,为平面正六边形,故B正确;
C.苯中不含双键,滴入溴水中,振荡后水层接近无色,不发生加成反应,发生萃取,故C错误;
故答案为:AB.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、速率计算及平衡判定、有机物的结构与性质为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
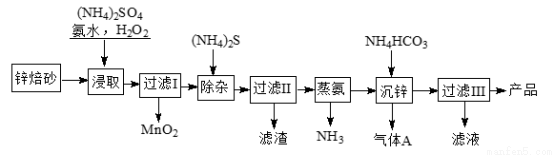
请回答下列问题:
(1)当(NH4)2SO4、NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42?)时,溶液呈 (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写两种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36;一般认为反应的平衡常数K>105,该反应进行基本完全。]
(5)“沉锌”的离子方程式为___________________。
(6)上述流程中多次需要过滤,实验室进行过滤操作需要用到的玻璃仪器有__________。“过滤III”所得滤液可循环使用,产品需洗涤干燥后备用,检验产品洗涤干净的操作和现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
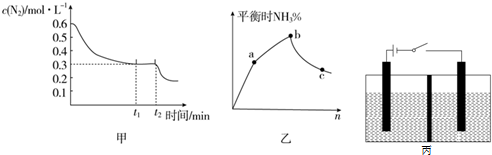
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
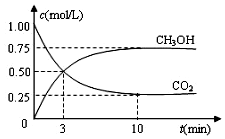 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示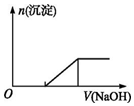 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com