
| A. | 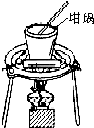 对溶液进行蒸发、浓缩、结晶 | |
| B. |  以己烯为萃取剂萃取溴水中的溴单质 | |
| C. | 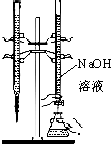 用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 | |
| D. | 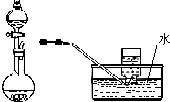 用稀硝酸与铜反应制取并收集NO |
分析 A.应在蒸发皿中加热液体;
B.己烯含有碳碳双键,可与溴水发生加成反应;
C.氢氧化钠溶液应放在碱式滴定管中;
D.稀硝酸与铜反应生成NO,NO不溶于水.
解答 解:A.加热液体应在蒸发皿中,坩埚用于加热固体,故A错误;
B.己烯含有碳碳双键,可与溴水发生加成反应,萃取时不能发生化学反应,故B错误;
C.氢氧化钠溶液可腐蚀玻璃,应放在碱式滴定管中,故C错误;
D.稀硝酸与铜反应生成NO,NO不溶于水,可用排水法收集NO,故D正确.
故选D.
点评 本题考查化学实验方案评价,为高考高频点,侧重考查物质分离和提纯、中和滴定、气体的收集,明确实验原理是解本题关键,从操作规范性、物质性质进行评价,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2H2S+O2→2S+2H2O | B. | 2H2S+3O2→2SO2+2H2O | ||
| C. | 2H2S+SO2→3S+2H2O | D. | 2SO2+O2→2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
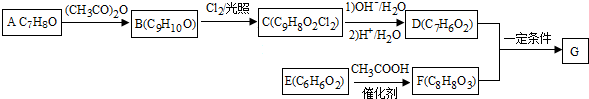
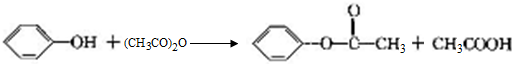
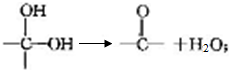

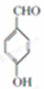
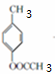 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$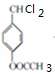 +2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH
+2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH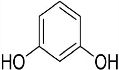 +CH3COOH$\stackrel{催化剂}{→}$
+CH3COOH$\stackrel{催化剂}{→}$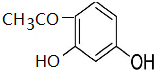 +H2O
+H2O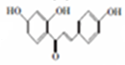
 (填结构简式)
(填结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
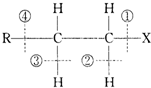
| A. | 该卤代烃发生水解反应时,被破坏的键是①和④ | |
| B. | 该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键是① | |
| D. | 当该卤代烃发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
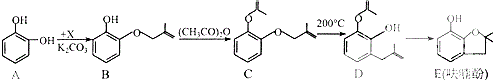
 .
.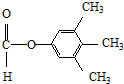 、
、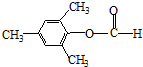 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
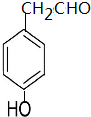
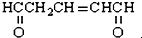 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A. | 1 mol 2 mol | B. | 1 mol 4 mol | C. | 3 mol 2 mol | D. | 3 mol 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
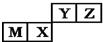
| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | X的最高价氧化物不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com