
| A. | 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA | |
| B. | 1molC8H18分子中含有的共用电子对数为26NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA | |
| D. | 常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA |
分析 A.氯气不足,转移电子的物质的量按照氯气的量计算;
B.每个C8H18分子中含有25个共用电子对,根据N=nNA计算分子数,再结合每个分子中含有的共用电子对数进行计算;
C.锌能与稀硫酸反应,生成的气体为氢气和二氧化硫的混合物;
D.环丙烷和聚乙烯的最简式均为CH2.
解答 解:A.标况下11.2L氯气的物质的量为0.5mol,0.5mol Cl2完全反应最多得到1mol电子,转移电子数为NA,故A错误;
B.1mol C8H18中含有NA个C8H18分子,每个C8H18分子中含有25个共用电子对,所以含有的共用电子对数为25NA,故B错误;
C.锌既能与浓硫酸反应又能与稀硫酸反应,故生成的标准状况下的气体2.24L即0.1mol气体中既有二氧化硫又有氢气.若0.1mol气体全部是二氧化硫,则消耗硫酸为0.2mol;若0.1mol气体全部是氢气,则消耗硫酸0.1mol.而现在0.1mol气体中既有二氧化硫又有氢气,故参加反应的硫酸在0.1mol到0.2mol之间,故C错误;
D.环丙烷和聚乙烯的最简式均为CH2,故5.6g混合物中含有的CH2的物质的量为n=$\frac{5.6g}{14g/mol}$=0.4mol,故含0.4NA个碳原子,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
对Na、Mg、Al的有关性质的叙述正确的是
A. 碱性:NaOH<Mg(OH)2<Al(OH)3 B. 第一电离能:Na<Mg<Al
C. 电负性:Na>Mg>Al D. 还原性:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 选项 | n(CO) | n(H2O) | n(CO2) | n(H2) |
| A | 0mol | 4mol | 2mol | 2mol |
| B | 0.5mol | 2.5mol | 0.5mol | 0.5mol |
| C | 1mol | 4mol | 0.5mol | 0.5mol |
| D | 0mol | 0mol | 1mol | 3mol |
| 物质 选项 | n(CO) | n(H2O) | n(CO2) | n(H2) |
| A | 0mol | 0mol | 1mol | 3mol |
| B | 2.5mol | 0.5mol | 0.5mol | 0.5mol |
| C | 3mol | 1mol | 0mol | 0mol |
| D | 0mol | 0mol | 3mol | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
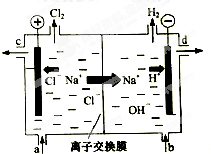 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.8g Na2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| B. | 标准状况下,11.2LSO3中含有的分子数目为0.5 NA | |
| C. | 常温常压下,46gNO2与 N2O4的混合气体含有的氮原子数目无法计算 | |
| D. | 0.1 mo1•L-1 MgC12溶液中含有的Mg2+数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 16g18O2中含有NA个氧原子 | |
| B. | 16gCH4中含有4NA个C-H 键 | |
| C. | 22g 某气体含分子数为 0.5NA,则其摩尔质量为 44 | |
| D. | 含 NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为 1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com