
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH= +131.4 kJ/mol,下列判断正确的是
A.水煤气反应中生成1 mol H2(g)吸收131.4 KJ热量
C.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)=C(s)+H2O(l) ΔH= -131.4 kJ/mol
D.水煤气反应中生成1体积CO(g)吸收131.4 KJ热量
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
常温下,下列各组离子一定能大量共存的是
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
B.[H+]=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C.[OH-]/ [H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32-
D.由水电离的[H+]=1.0×10-13 mol·L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作会导致实验结果偏高的是
A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B.中和滴定测定盐酸溶液浓度,量取20.00mL待测盐酸溶液的滴定管未用待测盐酸溶液润洗
C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量
D.配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所配溶液的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
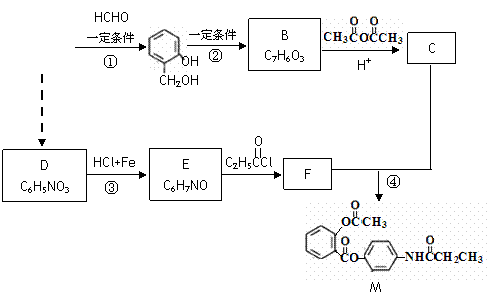 化合物M是某种解热镇痛药,以A为原料的工业合成路线如下图所示:
化合物M是某种解热镇痛药,以A为原料的工业合成路线如下图所示:
|
 已知:
已知:

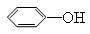 ① +
① +  + CH3COOH
+ CH3COOH
完成下列填空:
写出反应类型: 反应① 反应③ 。
A结构简式: 。由A合成D至少需要 个步骤才能完成。
写出反应④的化学方程式:
。
B的有苯环结构的同分异构体中有一种能在NaOH(aq)中发生水解。1mol该有机物最多消耗NaOH mol。写出满足下列条件所有的F的同分异构体的结构简式:
①是一种芳香族化合物; ②属α-氨基酸; ③苯环上有4种不同环境的氢原子
。 由 B不能一步完成,请解释可能的原因。
由 B不能一步完成,请解释可能的原因。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是

A.该反应的热化学方程式为:2NH3  N2+3H2 ΔH =-92 kJ·mol-1
N2+3H2 ΔH =-92 kJ·mol-1
B.正反应的活化能大于逆反应的活化能
C.a曲线是未加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作会导致实验结果偏高的是
A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B.中和滴定测定盐酸溶液浓度,量取20.00mL待测盐酸溶液的滴定管未用待测盐酸溶液润洗
C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量
D.配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所配溶液的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列混合溶液中,各离子浓度的大小顺序正确的是( )
A. 10 mL 0.1 mol ·L-1氨水与10 mL 0.1 mol ·L-1盐酸混合,
c(Cl-)>c(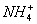 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. 10 mL 0.1 mol ·L-1NH4Cl溶液与5 mL 0.2 mol ·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10 mL 0.1 mol ·L-1CH3COOH溶液与5 mL 0.2 mol ·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10 mL 0.5 mol ·L-1CH3COONa溶液与6 mL 1 mol ·L-1盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com