

分析 氯气与铁反应生成三氯化铁,冷却得到三氯化铁固体,尾气中含有氯气,用氯化亚铁溶液吸收得到氯化铁溶液,把氯化铁固体溶于吸收液得到浓氯化铁溶液,氯气与氢氧化钠溶液反应生成次氯酸钠溶液,次氯酸钠具有强氧化性,与氯化铁溶液反应生成Na2FeO4,然后向该溶液中加饱和的KOH溶液,析出固体K2FeO4.
(1)①用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;②氯化铁做净水剂是因为Fe3+水为Fe(OH)3胶体的缘故;
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2;Cl2与氢氧化钠反应生成NaClO和NaCl,其中NaClO能做氧化剂;
(3)碱性条件下根据反应物和产物及元素守恒和电荷守恒可写出反应①的离子方程式;
(4)依据溶度积常数和铁离子浓度计算氢氧根离子浓度,结合离子积常数计算氢离子浓度得到铁离子沉淀的PH;过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品.该反应的化学方程式为2KOH+Na2FeO4 =K2FeO4+2NaOH,K2FeO4溶解度小,析出晶体,促进反应进行;
(5)洗涤剂的选择要求:要对K2FeO4水解能起到抑制作用的试剂.
解答 解:(1)①用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中还生成氢氧化钠,所以电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,离子反应方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
②氯化铁做净水剂是因为Fe3+水为Fe(OH)3胶体的缘故,原理为Fe3++3H2O?Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2;Cl2与氢氧化钠反应生成NaClO和NaCl,其中NaClO能做氧化剂,所以Y为NaClO,
故答案为:FeCl2;NaClO;
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(4)25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5mol/L,Ksp=c(Fe3+)×c3(OH-),c3(OH-)=$\frac{4.0×1{0}^{-38}}{4.0×1{0}^{-5}}$=10-33;c(OH-)=10-11mol/L
c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,铁离子沉淀的溶液PH=3;过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品.该反应的化学方程式为2KOH+Na2FeO4 =K2FeO4+2NaOH,K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大;K2FeO4在水溶液中易发生反应:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑,
故答案为:3;K2FeO4溶解度小,析出晶体,促进反应进行;
(5)洗涤剂的选择要求:要对K2FeO4水解能起到抑制作用的试剂,在选项中,A能让K2FeO4水解,B中稀KOH溶液显碱性,对K2FeO4水解能起到抑制作用,C和D中的铵根和三价铁离子易水解,且水解后显酸性,对K2FeO4水解能起到促进作用,故选B,
故答案为:B.
点评 本题考查了物质的制备流程的理解应用、盐类水解原理、物质性质的分析应用、沉淀溶解平衡计算等,题目涉及的知识点较多,侧重于考查学生的实验能力和对基础知识的综合应用能力,熟练掌握基础是关键,题目难度中等.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 晶体名称 | 碘化钾 | 干冰 | 硫 | 碘 |
| 晶体中的微粒名称 | 阴、阳离子 | 分子 | 原子 | 分子 |
| 晶体内存在的结合力 | 离子键 | 范德华力 | 共价键 | 范德华力 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
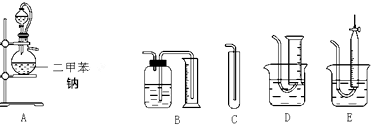
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浊液a中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) | |
| B. | 若向滤液b中滴加0.01mol•L-1Na2SO4溶液,无明显现象 | |
| C. | 若向滤液b中滴加0.01mol•L-1BaCl2溶液,会出现白色沉淀 | |
| D. | 若向滤液b中滴加0.01mol•L-1AgNO3溶液,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
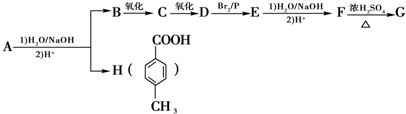
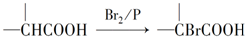
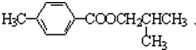 .
.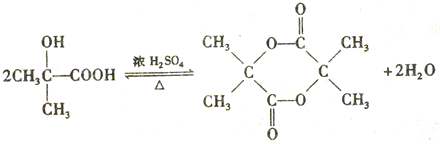 .
.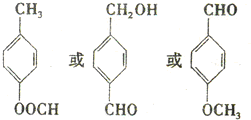 .
. )结构.
)结构.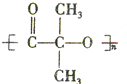 ,形成该聚合物的反应类型为:缩聚反应.
,形成该聚合物的反应类型为:缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(Cl{O}^{-})}$增大 | |
| B. | 溶液中c(ClO-)>c(HClO)>c(OH-)>c(H+) | |
| C. | 溶液中2c(Ca2+)+c(H+)=c(ClO-)+c(OH-) | |
| D. | 若溶液的pH=l2,则c(ClO-)的水解百分率约为9.1% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有甲烷 | D. | 一定有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中NH3的物质的量一定增加了0.30mol | |
| B. | 容器中H2O(g)的物质的量至少为0.45mol | |
| C. | NH3的平均反应速率为0.010mol/(L•s) | |
| D. | NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com