
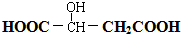 . 请回答:
. 请回答: .
. 分析 苹果醋分子中含有2个羧基,具有酸性,可发生中和、酯化反应,含有羟基,可发生取代、氧化和消去反应,以此解答.
解答 解:(1)由结构简式可知分子式为C4H6O5,故答案为:C4H6O5;
(2)含有2个羧基,则1mol 苹果酸与足量碳酸氢钠溶液反应,生成2mol二氧化碳气体,标准状况下气体的体积为44.8L,故答案为:44.8;
(3)含有羧基,可发生中和、酯化反应,含有羟基,可发生氧化反应,不能发生加成反应,故答案为:ABD;
(4)①分子中含有2个羧基,可与氢氧化钠发生中和反应,反应的方程式为HOOCCH(OH)CH2COOH+2NaOH→NaOOCCH(OH)CH2COONa+2H2O,
故答案为:HOOCCH(OH)CH2COOH+2NaOH→NaOOCCH(OH)CH2COONa+2H2O;
②苹果酸中的醇羟基能和乙酸发生酯化反应生成酯和水,反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查醇、羧酸的性质,注意羧基或羟基与氢气之间的关系式,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为:Fe-2e-═Fe2+ | B. | 电解过程中pH不变 | ||
| C. | 过程中有Fe(OH)3生成 | D. | 上述反应中Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
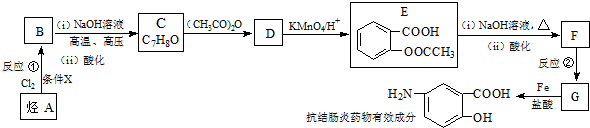
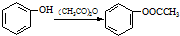
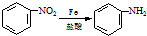
 ;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应;
;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应; ;
;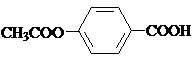 ,
, ;
;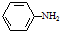 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(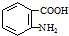 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)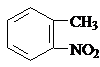 ,
,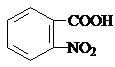 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
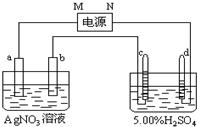
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 工业上用电解MgCl2溶液的方法冶炼Mg | |
| B. | 钢铁发生吸氧腐蚀的正极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 如图中发生反应的方程式为:Fe+2H+=Fe2++H2↑ | |
| D. | 碱性锌锰干电池放电时的正极反应为:MnO2+H2O+e-=MnOOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、Fe | B. | Fe、Mg | C. | Al、Mg | D. | Zn、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和晶体硅 | B. | CO2和SiO2 | C. | KCl和HBr | D. | NaOH和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯分子中2个碳原子都是sp2杂化,乙烯分子有5个σ键 | |
| D. | 乙烯和环丙烷(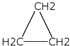 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com