
| S2O | 2- 3 |
| S4O | 2- 6 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入 |
无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管Ⅱ中加入 |
证明以I-形式存在 |
| V×10-4×127g/mol |
| ag |
| 1.27V |
| a |
| 1.27V |
| a |


科目:高中化学 来源:2012-2013学年广东省茂名市高三第一次高考模拟考试理综化学试卷(解析版) 题型:实验题
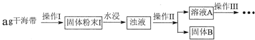
碘元素有“智力元素”之称。研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量。

(1)操作I为灼烧,则灼烧时用____盛装海带,操作II为____________________________;
(2)水浸时通常要将悬浊液煮沸2~3min,目的是______________________________;
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
[推测]:①以IO3ˉ形式存在; ②以Iˉ形式存在
[查阅资料]:IO3ˉ具有较强的氧化性,I2+2S2O32ˉ=2Iˉ+S4O62ˉ
将上述溶液稀释配制成200mL溶液,请完成下列实验探究。限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸。
|
序号 |
实验方案 |
实验现象 |
结论 |
|
① |
取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II |
无现象 |
|
|
② |
往试管I中加入______ |
无现象 |
证明不是以IO3ˉ形式存在 |
|
③ |
往试管II中加入_______ |
_______________ |
证明以 |
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将Iˉ氧化为I2并得到溶液B;
②在溶液B加入两滴淀粉溶液,用0.01mol/LNa2S2O3溶液,滴定至终点,终点现象为___________,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量_________________.(假设操作I、II过程中碘不损失,相对原子量I-127)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com