
| A. | 用物质A表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质A的转化率为70% | |
| D. | 2 s 时物质B的浓度为 0.7 mol•L-1 |
分析 将 4mol A气体和 2mol B气体在 2L 固定体积的容器中,若经2s后测得C的浓度为 0.6mol•L-1,生成的C的物质的量=0.6mol/L×2L=1.2mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):4 2 0
变化量(mol):1.2 0.6 1.2
2s末量(mol):2.8 1.4 1.2
A.根据v=$\frac{△c}{△t}$计算v(A);
B.根据v=$\frac{△c}{△t}$计算v(B);
C.转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
D.根据c=$\frac{n}{V}$计算.
解答 解:将 4mol A气体和 2mol B气体在 2L 固定体积的容器中,若经2s后测得C的浓度为 0.6mol•L-1,生成的C的物质的量=0.6mol/L×2L=1.2mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):4 2 0
变化量(mol):1.2 0.6 1.2
2s末量(mol):2.8 1.4 1.2
A.v(A)=$\frac{\frac{1.2mol}{2L}}{2s}$=0.3mol/(L•s),故A错误;
B.v(B)=$\frac{\frac{0.6mol}{2L}}{2s}$=0.15mol/(L•s),故B错误;
C.A转化率=$\frac{1.2mol}{4mol}$×100%=30%,故C错误;
D.2s时B的浓度为$\frac{1.4mol}{2L}$=0.7mol/L,故D正确,
故选:D.
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意掌握三段式解题法在化学平衡计算中应用,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| B. | 在0.1mol•L-1的CH3COONa溶液中:n(OH-)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) | |
| C. | 向AgBr的饱和溶液中加入NaCl固体,有白色固体析出,说明AgCl比AgBr更难溶 | |
| D. | 10mL0.1mol•L-1H2SO4与10mL 0.01mol•L-1NaOH溶液充分混合,若混合后的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液里含有NA个SO42- | |
| B. | 1L溶液里K+离子数比SO42-离子数少NA个 | |
| C. | 2L溶液里,阴、阳离子的总数大于4NA个 | |
| D. | 2L溶液里,Al3+离子个数一定小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
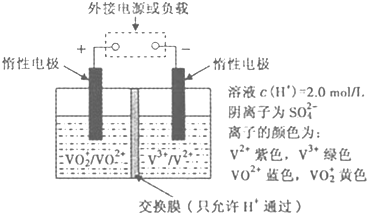
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
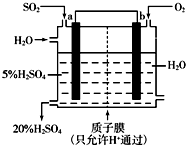 在硫酸工业中,SO2转化为SO3是一个关键步骤
在硫酸工业中,SO2转化为SO3是一个关键步骤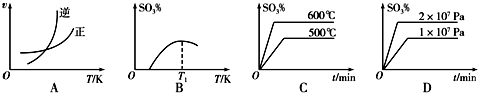
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量C02通入氢氧化钙溶液中:CO2+OH-═HCO3- | |
| B. | Na202加入H2180中:2Na2O2+2H218O═4Na++4OH-+18O2↑ | |
| C. | 硅与氢氟酸的反应:Si+4H++4F-═SiF4↑+2H2↑ | |
| D. | 水玻璃中通人过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO32-+H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 过氧化氢的电子式
过氧化氢的电子式
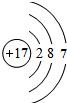 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com