
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 常温常压下,28g乙烯与丁烯的混合气体含有的碳原子数目NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA | |
| D. | 标准状况下,22.4L HF含有的分子数目为NA |
分析 A、求出乙烷的物质的量,然后根据乙烷中含6条极性共价键来分析;
B.乙烯与丁烯的最简式均为CH2,计算28gCH2 中含有的碳原子数目;
C.一氧化氮和氧气反应生成二氧化氮,NO2和N2O4之间存在转化,方程式2NO2?N2O4;
D.标准状况下HF不是气体;
解答 解:A、30g乙烷的物质的量=$\frac{30g}{30g/mol}$=1mol,而乙烷中含6条极性共价键,故1mol乙烷中含极性共价键6NA条,故A错误;
B.常温常压下,28g乙烯与丁烯的混合气体中CH2物质的量=$\frac{28g}{14g/mol}$=2mol,含有的碳原子数目2NA,故B错误;
C.NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于2NA,故C正确;
D.标准状况下HF不是气体,22.4L HF物质的量不是1mol,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的综合应用,熟练掌握物质的量与阿伏伽德罗常数、化学键数等等物理量之间关系是解题关键,注意气体摩尔体积的应用条件分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
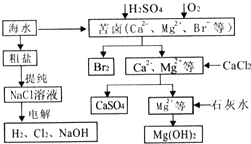 工业上对海水资源综合开发利用的部分工艺流程如图所示.
工业上对海水资源综合开发利用的部分工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y | |
| B. | Y形成的离子与Z形成的离子的电子数可能相同 | |
| C. | 化合物ZY、WY3 中化学键的类型相同 | |
| D. | 由X、Y、Z、W组成的化合物的水溶液不可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 | |
| B. | 乙酸乙酯和食用植物油均可水解生成乙醇 | |
| C. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| D. | 生物柴油和石化柴油相比,使用生物柴油环保,可以减少SO2的排放,且生物柴油属于可再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 侯氏制碱法 | 人工合成胰岛素 | 用青蒿素治疗疟疾 | 独创无氰电镀新工艺 |
 |  |  |  |
| A.以NH3、CO2、NaCl为原料最终制得纯碱 | B.由有机小分子合成有机高分子 | C.用萃取原理从青蒿素中提取青蒿素 | D.以铜盐、碱等溶液为电解质镀铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为79、质子数为55 的铯(Cs)原子:${\;}_{55}^{79}$Cs | |
| B. | N2分子的电子式: | |
| C. | HOCH2COOH缩聚物的结构简式: | |
| D. | 镁离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
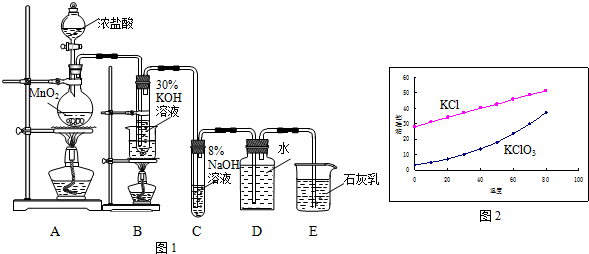
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com