
(14分)A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是 。
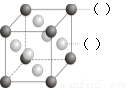
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3:1
形成的合金晶胞图,在图中的括号内写出对应的元素符号。B、D元素最高价
氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
⑴sp3(2分);⑵3d104s1(2分) 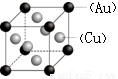 (2分);⑶HClO4>H2SO4 (2分);
(2分);⑶HClO4>H2SO4 (2分);
⑷ 2H++NO3-+e-=NO2↑+H2O(2分) ⑸ 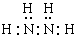 (2分)
(2分)
⑹C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol(2分)
【解析】
试题分析:A、B、C、D、E、F为前四周期的元素,其中,A元素和B元素的原子都有一个未成对电子,B原子得一个电子后3p轨道全充满,则B是Cl元素,A3+比B-少一个电子层,则A是Al元素;C原子的p轨道中有3个未成对电子,则位于第VA族,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大,则C是N元素;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池,则D是S元素;E元素的基态原子核外有六种运动状态的电子,有几种运动状态的电子则就有几个电子,则E是C元素;F元素的单质为紫红色固体,可通过“湿法冶金”而得,则F是Cu元素,所以
(1)NCl3分子中心原子含有3个σ键和1个孤电子对,所以N原子的杂化类型是sp3;
(2)F是Cu元素,铜原子核外有29个电子,3d能级上排列10个电子,4s能级上排列1个电子,所以Cu元素的原子的外围电子排布式为3d104s1,Cu与Au以3:1形成的合金晶胞图,利用均摊法得,黑色小球个数=8× =1,灰色小球的个数=6×
=1,灰色小球的个数=6×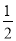 =3,所以黑色小球表示Au原子,灰色小球表示Cu原子,其图象为
=3,所以黑色小球表示Au原子,灰色小球表示Cu原子,其图象为 ;
;
(3)同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以Cl元素的非金属性大于S元素,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以酸性HClO4>H2SO4;
(4)用导线将Al和Cu的单质做成的电极连接起来,插入到盛有N的最高价氧化物的水化物的浓溶液中构成原电池,铜易失电子而作负极,铝作正极,正极上硝酸根离子得电子发生还原反应,电极反应式为2H++NO3-+e-=NO2↑+H2O;
(5)分子R是由N元素与氢元素形成的18电子分子,R为N2H4,R的电子式为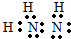 ;
;
(6)24g C的单质在33.6L氧气(标准状况)中燃烧,至反应物全部耗尽,放出xkJ热量,24gC的物质的量=24g÷12g/mol=2mol,n(O2)=33.6L÷22.4L/mol=1.5mol,根据原子守恒知该反应热化学反应方程式为:2C(s)+1.5O2(g)=CO(g)+CO2 △H=-xkJ/mol,E的燃烧热为y kJ/mol,其完全燃烧热化学反应方程式为C(s)+O2(g)=CO(g)2 △H=-ykJ/mol,1mol C与O2反应生成C的低价氧化物时的热化学方程式为C(s)+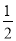 O2(g)=CO(g)△H=-(x-y)kJ/mol。
O2(g)=CO(g)△H=-(x-y)kJ/mol。
考点:本题考查较综合,涉及盖斯定律、电极反应式的书写、电子式的书写等


科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
有四种物质:NaHCO3溶液、NaOH溶液、盐酸、铁粉。它们两两之间发生的反应最多
A.3个 B.4个 C.5个 D.6个
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:填空题
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
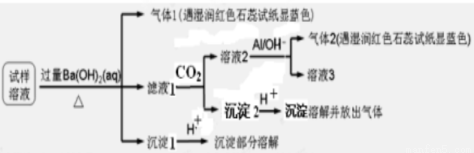
已知:3NO3-+8Al+5OH-+2H2O 3NH3+8AlO2-
3NH3+8AlO2-
根据以上的实验操作与现象对下列说法进行判断:
(1)试样中肯定存在的离子是_________________________
(2)沉淀1的成分为_______________________________
(3)下列说法正确的是( )
A.该雾霾中可能存在NaNO3、NH4Cl、MgSO4
B.试样中一定不含Al3+
C.PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物,PM2.5分散在空气中形成的混合物属于胶体
D.大量燃烧化石燃料是造成雾霾天气的一种重要因素
(4)Al3+可以与碱反应生成Al(OH)3沉淀,写出实验室制取Al(OH)3的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列有关物质的应用说法正确的是()
A.生石灰用作食品抗氧化剂
B.FeCl3溶液能被铜置换,可用于铜质印刷线路板制作
C.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D.氢氧化铝可作胃酸的中和剂
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.1.0mol·L-1KNO3溶液:H+、Fe2+、SCN-、SO42-
B.c(H+)/c(OH-)=10-10的溶液:Ba2+、NO3-、Cl-
C.中性溶液:Fe3+、K+、Cl-、SO42-
D.c(ClO-)=1.0mol·L-1的溶液:Na+、SO32-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:选择题
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是( )
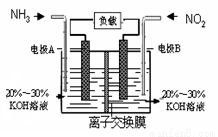
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:选择题
水是生命之源,下列关于水的说法正确的是
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B.某温度下,pH=6的蒸馏水显酸性
C.氯气有毒,因而自来水的杀菌消毒一定不能使用氯气
D.明矾可用于水的净化与杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三(补习班)10月月考理综化学试卷(解析版) 题型:选择题
用NA表示阿弗加德罗常数,下列说法正确的是
A.0.2 mol H2O2完全分解转移的电子数为0.4NA
B.300 mL 2 mol·L-1的蔗糖溶液中所含分子数为0.6NA
C.在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA
D.在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com