
【题目】铝在酸性或碱性溶液中均可与NO3—发生氧化还原反应,转化关系如下图所示:
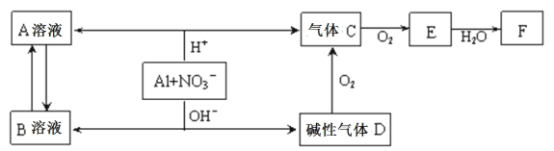
下列说法错误的是
A.B溶液含[Al(OH)4]—
B.A溶液和B溶液混合无明显现象
C.D与F反应生成盐
D.E排入大气中会造成污染
【答案】B
【解析】
根据图像可知,Al在酸性条件下与硝酸根离子反应生成硝酸铝、NO和水,则溶液A为硝酸铝,气体C为NO;气体E则为二氧化氮,F为硝酸;铝在碱性条件下与硝酸根离子反应生成偏铝酸钠和氨气,则溶液B为偏铝酸钠,气体D为氨气。
A. 铝在碱性条件下与硝酸根离子反应生成偏铝酸钠和氨气,偏铝酸根离子可写为[Al(OH)4]—,与题意不符,A错误;
B. 硝酸铝溶液和偏铝酸钠溶液混合时,发生双水解,产生氢氧化铝沉淀,符合题意,B正确;
C. D、F分别为氨气、硝酸,可反应生成硝酸铵,属于盐类,与题意不符,C错误;
D. E为二氧化氮,有毒排入大气中会造成污染,与题意不符,D错误;
答案为B。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷燃烧热为890.3 kJmol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJmolˉ1
C.H2燃烧热为285.8kJmolˉ1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJmolˉ1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醇常用作有机反应的溶剂。实验室制备正丁醚的主要实验装置如图:
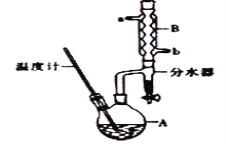
反应物和产物的相关数据如表:
相对分子质量 | 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成正丁醚的步骤:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯;
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mLNaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g。
请回答:
(1)加热A前,需先从_________(填“a”或“b”)口向B中通入水。
(2)写出步骤②中制备正丁醚的化学方程式____________________________________。
(3)步骤③的目的是初步洗去____________________,振摇后静置,粗产物应从分液漏斗的_____(填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为_______________________________________。
(5)步骤⑤中,加热蒸馏时应收集________(填选项字母)左右的馏分。
a.100℃b.117℃c.135℃d.142℃
(6)本实验中,正丁醚的产率为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.1 mol Cl2参加反应转移电子数一定为2NA
B.在反应KIO3 + 6HI = KI + 3I2 +3H2O中,每生成3 mol I2转移的电子数为6NA
C.根据反应中HNO3(稀)![]() NO,而HNO3(浓)
NO,而HNO3(浓)![]() NO2可知,氧化性:HNO3(稀) > HNO3(浓)
NO2可知,氧化性:HNO3(稀) > HNO3(浓)
D.含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容器内进行某一反应,M、N的物质的量随反应时间变化的曲线如下图所示,则下列叙述中,正确的是( )

A. 反应的化学方程式一定为2M![]() N
N
B. ![]() 时,逆反应速率一定大于正反应速率
时,逆反应速率一定大于正反应速率
C. ![]() 时,反应达到了化学平衡状态
时,反应达到了化学平衡状态
D. ![]() 时,正反应速率等于逆反应速率
时,正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E、F、G都是周期表中前四周期的元素,他们的原子序数依次增大。其中A原子的L层有2个未成对电子。D是电负性最大的元素,E与F同主族,E的二价阳离子与C的阴离子具有相同的电子层结构。G3+离子3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的順序为______________________。D的核外有______________种运动状态不同的电子。
(2)A的最简单氢化物属于___________(填“极性分子”和“非极性分子”)。![]() 离子空间构型是__________,其中心原子采取__________________杂化。
离子空间构型是__________,其中心原子采取__________________杂化。
(3)晶体熔点:EC_________FC(填“>”、“<”或“=”)
(4)G和M(质子数为25)两元素的部分电离能数据列于表:
元素 | M | G | |
电离能(kJmol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态G2+再失去一个电子难。其原因是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
![]() 浓硝酸通常保存在棕色试剂瓶中
浓硝酸通常保存在棕色试剂瓶中
![]() 检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
![]() 锌与稀硝酸反应可以得到氢气
锌与稀硝酸反应可以得到氢气
![]() 足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
![]() 浓硫酸滴到纸张上变黑,说明浓硫酸具有脱水性
浓硫酸滴到纸张上变黑,说明浓硫酸具有脱水性
![]() 浓硫酸使胆矾变白,说明浓硫酸具有脱水性
浓硫酸使胆矾变白,说明浓硫酸具有脱水性
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1843年伦敦泰晤士河隧道终于竣工,英国政界人物在隧道里举行了庆典。但带到隧道的香槟酒没有气泡使庆祝变得索然无味,当庆典过后,走出隧道的人们又有尴尬的事发生了:酒在肚子里发胀,酒气从鼻子、嘴里不断冒出来,有的人穿的马甲被胀开。请回答下列问题:
(1)香槟酒、啤酒、碳酸饮料在开瓶时会观察到有气泡冒出,请你写出与该现象有关的化学平衡方程式:_____。
(2)泰晤士河隧道竣工庆典的尴尬说明_____________________对化学平衡移动存在影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com