
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 | |
| ① | ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ② | 3818Ar | 18 | 20 | 18 | 38 |
| ③ | 3216S2- | 16 | 16 | 18 | 32 |
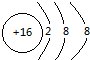 Mg2+
Mg2+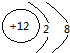 .
. 分析 (1)AZX在该原子符号中左上角的A表示质量数,左下角的Z表示质子数,中子数=质量数-质子数,电子数=质子数,据此分析;
(2)S2-的核内有16个质子,核外有18个电子;Mg2+的核内有12个质子,核外有10个电子.
解答 解:(1)AZX在该原子符号中左上角的A表示质量数,左下角的Z表示质子数,中子数=质量数-质子数,电子数=质子数.
①4019K的质量数为40,质子数为19,电子数为19,中子数=40-19=21;
②质子数为18,则为Ar原子,故电子数为18,而中子数为20,故质量数为38,故符号为3818Ar;
③由于质量数为32,而中子数为16,故质子数为16,而电子数为18,故为3216S2-.
故答案为:
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 | |
| ① | ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ② | 3818Ar | 18 | 20 | 18 | 38 |
| ③ | 3216S2- | 16 | 16 | 18 | 32 |
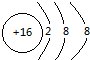 ;Mg2+的核内有12个质子,核外有10个电子,故结构示意图为
;Mg2+的核内有12个质子,核外有10个电子,故结构示意图为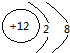 ,故答案为:
,故答案为: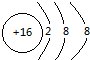 ;
;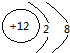 .
.点评 本题考查了微粒中各种粒子之间的关系,难度不大,应注意的是质量数=质子数+中子数.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备Fe(NO3)2溶液:将铁粉溶于过量的稀硝酸 | |
| B. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯中加入过量氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的平衡球,分别置于冷水和热水中,观察气体颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的裂化、煤的液化、蛋白质的盐析、焰色反应都是化学变化 | |
| B. | 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料 | |
| C. | 铅蓄电池是常见的二次电池.性能优良.比能量高.缺点是废弃电池污染严重 | |
| D. | 在新型催化剂条件下通过电力可将二氧化碳氧化为甲醇、甲烷等燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:
已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据以上信息,可推断CH3COOH为弱电解质 | |
| B. | 加水稀释过程中,c(H+)•c(OH-) 的值增大 | |
| C. | 加入NaOH固体可抑制 CHCOO-的水解 | |
| D. | 同pH的CH3COONa溶液和NaOH溶液,由水电离出的c(H+) 前者大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com