
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 等物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,则a+1=b | |
| D. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
分析 A.溶液pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(HSO3-)+2c(SO32-);
B.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③醋酸根离子水解促进铵根离子水解;④弱碱电离,且电离的程度很弱;
C.醋酸的浓度越大,电离程度越小;
D.反应后溶质为等浓度的醋酸钠和醋酸,溶液为酸性,则醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),再结合物料守恒可得c(CH3COO-)>c(Cl-)>c(CH3COOH).
解答 解:A.pH=7的NaHSO3与Na2SO3混合溶液中:c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(HSO3-)+2c(SO32-),故A错误;
B.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4④NH3•H2O,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③醋酸根离子水解促进铵根离子水解;④弱碱电离,且电离的程度很弱,则c(NH4+)由大到小的顺序是①>②>③>④,故B正确;
C.0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,前者醋酸的电离程度越小后者,则a+1>b,故C错误;
D.0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则c(H+)>c(OH-),溶质为等浓度的醋酸钠和醋酸,溶液为酸性,则醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),再结合物料守恒可知c(CH3COO-)>c(Cl-)>c(CH3COOH),则溶液中正确的离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、酸碱混合的定性判断、离子浓度大小比较等知识,明确反应后溶质组成为解答关键,C为易错点,注意醋酸浓度越大,电离程度越小.


科目:高中化学 来源: 题型:填空题
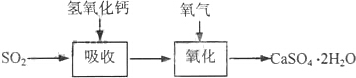
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
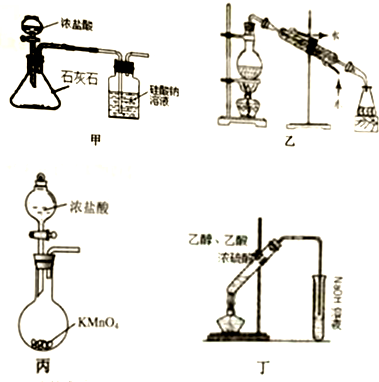
| A. | 装置甲:验证碳的非金属性比硅强 | |
| B. | 装置乙:石油分馏分别得到汽油、柴油、煤油 | |
| C. | 装置丙:实验室制取氯气的反应发生装置 | |
| D. | 装置丁:实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
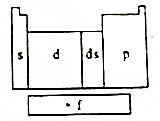 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.
在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.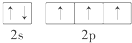 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: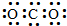 | B. | 乙烯的比例模型: | ||
| C. | 醋酸钠的分子式:C2H3O2Na | D. | C原子最外层电子的轨道表示式: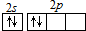 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com