
����Ŀ��ij�������Ƹ﹤ҵ�����еĸ�Ԫ����������CrOH(H2O)5SO4����ʽ���գ������������£����������ȡҺ�еĽ���������Ҫ��Cr3+�������Fe3+��Al3+��Ca2+��Mg2+��

�ش��������⣺
��1��4.8 mol/L��������Һ�ܶ�Ϊ1.27g/cm3������Һ�����������������_______��
��2��H2O2�������ǽ���Һ���е�Cr3+ת��ΪCr2O72����д���˷�Ӧ�����ӷ���ʽ��______��
��3�������£�����������������������ʽ����ʱ��Һ��pH���£�
������ | Fe3+ | Mg2+ | Al3+ | Cr3+ |
��ʼ����ʱ��pH | 2.7 | �� | �� | �� |
������ȫʱ��pH | 3.7 | 11.1 | 5.4��>8�ܽ⣩ | 9��>9�ܽ⣩ |
��Cr (OH)3�ܽ���NaOH��Һʱ��Ӧ�����ӷ���ʽ��___________��
�ڼ���NaOH��Һʹ��Һ�ʼ��ԣ�Cr2O72��ת��ΪCrO42������Һ������������Ҫ��______������Һ��pH���ܳ���8����������______________________________��
��4�������ӽ�����֬�ķ�Ӧԭ��ΪMn++nNaR��MRn+nNa+�����������ӽ�����֬��ȥ��Һ���еĽ�����������_____________��
��5��д��������������SO2���л�ԭʱ������Ӧ�Ļ�ѧ����ʽ��_______________��
���𰸡� 37% 2Cr3+ + 3H2O2 + H2O![]() Cr2O72��+ 8H+ Cr (OH)3 + OH-
Cr2O72��+ 8H+ Cr (OH)3 + OH-![]() CrO2��+ 2H2O Na+��Ca2+��Mg2+ pH����8��ʹ����Al(OH)3�ܽ�����AlO2�� Ca2+��Mg2+ 3SO2 + 2Na2CrO4 +12H2O
CrO2��+ 2H2O Na+��Ca2+��Mg2+ pH����8��ʹ����Al(OH)3�ܽ�����AlO2�� Ca2+��Mg2+ 3SO2 + 2Na2CrO4 +12H2O![]() 2CrOH(H2O)5SO4�� + Na2SO4 + 2NaOH
2CrOH(H2O)5SO4�� + Na2SO4 + 2NaOH
����������������������̿�֪���������ྭ�������ˣ�����Һ�м���˫��ˮ��Cr3+����ΪCr2O72����Ȼ���������������Һ����pH��8��Cr2O72��ת��ΪCrO42��,Fe3+��Al3+��ȫ���������ˣ���Һ�������ӽ�����֬�������ӽ�������ȥCa2+��Mg2+���������Һ��ͨ�������Ķ�������CrO42����ԭΪCrOH(H2O)5SO4��
��1��4.8 mol/L��������Һ�ܶ�Ϊ1.27g/cm3������Һ�����������������![]() 37%��
37%��
��2�� H2O2�������ǽ���Һ���е�Cr3+ת��ΪCr2O72�����˷�Ӧ�����ӷ���ʽ��2Cr3+ + 3H2O2 + H2O![]() Cr2O72��+ 8H+��
Cr2O72��+ 8H+��
��3�������Al(OH)3����NaOH��Һ�ķ�Ӧ��Cr (OH)3�ܽ���NaOH��Һʱ��Ӧ�����ӷ���ʽ��Cr (OH)3 + OH-![]() CrO2��+ 2H2O��
CrO2��+ 2H2O��
�ڼ���NaOH��Һʹ��Һ�ʼ��ԣ�Cr2O72��ת��ΪCrO42������Һ������������Ҫ��Na+��Ca2+��Mg2+������Һ��pH���ܳ���8����������pH����8��ʹ����Al(OH)3�ܽ�����AlO2����
��4�������ӽ�����֬�ķ�Ӧԭ��ΪMn++nNaR��MRn+nNa+�����������ӽ�����֬��ȥ��Һ���еĽ�����������Ca2+��Mg2+��
��5��������������SO2���л�ԭʱ������Ӧ�Ļ�ѧ����ʽΪ3SO2 + 2Na2CrO4 +12H2O![]() 2CrOH(H2O)5SO4�� + Na2SO4 + 2NaOH��
2CrOH(H2O)5SO4�� + Na2SO4 + 2NaOH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֲ�ͬ�ѻ���ʽ�Ľ�������ľ�����ͼ��ʾ���й�˵����ȷ���ǣ�������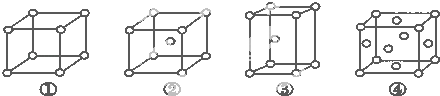
A.��Ϊ�������ѻ���Ϊ�������ܶѻ���Ϊ���������ѻ���Ϊ�����������ܶѻ�
B.ÿ���������е�ԭ�����ֱ�Ϊ����1������2������2������4��
C.������ԭ�ӵ���λ���ֱ�Ϊ����6����8����8����12
D.�ռ������ʵĴ�С��ϵΪ���٣��ڣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о�ԭ���ԭ���������ͼװ�á�������������ȷ����

A. a��b������ʱ��Fe����������ɫ����
B. a��b����ʱ��SO42-��Fe���ƶ�
C. ����ԭ��ؿ����ṩ�������ȶ��ĵ���
D. ��ԭ��ط�Ӧ�����ӷ���ʽΪ��Cu2++Fe=Cu+Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���͵�أ���NaBH4��B�Ļ��ϼ�Ϊ+3�ۣ���H2O2��ԭ�ϣ��������ϲ���Pt���������ϲ���MnO2�������缫�����ֶԸü��ĵ缫��Ӧ���д����ã����õ�ؿ��������ǡ���ˮ��̽������������Դ���乤��ԭ����ͼ��ʾ������˵������ȷ����

A. ÿ����3mol H2O2��ת��6mol e��
B. ��ع���ʱNa+��b��������a����
C. a���ϵĵ缫��ӦʽΪ��BH4��+8OH����8e���TBO2��+6H2O
D. b��������MnO2���õ���ܷ�Ӧ����ʽ��NaBH4 + 4H2O2===NaBO2 + 6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������W��Y��X��Zλ��ͬһ���壬W��X���γɹ��ۻ�����WX2��Yԭ�ӵ��ڲ������������������������2.5����������������ȷ����
A. ԭ�Ӱ뾶�Ĵ�С˳��ΪX<W<Y<Z B. WX2��YX2��ZX2��ֻ�����ۼ�
C. W��X��Y��Z����������֮��Ϊ20 D. Z����̬�⻯���Y���ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ:X(s)+Y(g)![]() 2Z(g)���ݻ�Ϊ1L�ܱ�������Ӧ�������������Ƿ�Ӧ�ﵽƽ��״̬�ı�־����
2Z(g)���ݻ�Ϊ1L�ܱ�������Ӧ�������������Ƿ�Ӧ�ﵽƽ��״̬�ı�־����
�ٵ�λʱ��������1molX��ͬʱ����2molZ ��Z������������ٱ仯
����ϵ��ѹǿ���ٸı� ��Y��Z�����ʵ���Ũ�ȱ�Ϊ1:2
��Y��ת���ʲ��ٸı��״̬ ���������ܶȲ��ٸı��״̬
A. ���٢� B. �٢ۢ� C. �٢ܢ� D. �ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1��������̬����BCl3��CCl4��H2O��BeCl2�У�������ɴ�С��˳��Ϊ ��
��2�����⣨H2S�����ӵĿռ乹��Ϊ��������̼��CO2�����ӵĿռ乹��Ϊ�����飨CH4�����ӵĿռ乹��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)Ϊ����֤Fe3+��Cu2+������ǿ��������װ���ܴﵽʵ��Ŀ�ĵ���_______��

(2)��CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ����ͼ��ʾ(A��BΪ���̼��)��
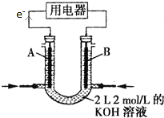
A����缫��ӦʽΪ___________��
(3)ijԪ�ص�ͬλ��![]() �������Ȼ���XCl21.11g����ˮ�����Һ����1mo1/L��AgNO3��Һ20mL��ǡ����ȫ��Ӧ��������ͬλ�ص�ԭ�Ӻ�����20�����ӣ�Z��ֵΪ_____��A��ֵΪ______��
�������Ȼ���XCl21.11g����ˮ�����Һ����1mo1/L��AgNO3��Һ20mL��ǡ����ȫ��Ӧ��������ͬλ�ص�ԭ�Ӻ�����20�����ӣ�Z��ֵΪ_____��A��ֵΪ______��
(4)������NH4Br�����ܱ������У���ij�¶��£��������з�Ӧ��
NH4Br(s)![]() NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)![]() Br2(g)+H2(g)
Br2(g)+H2(g)
2min��֪c(H2)=0.5mo/L��c(HBr)=4mol/L����������Ӧ������v(NH3)��ʾ����v(NH3)=_____
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com