
氮化镁是科学家们制备的一种重要化合物,它可由单只直接化合而成,它与水作用的产物之一为NH3。请回答下列问题:
(1)Mg3N2是由______键形成的_____化合物,写出它的电子式:_______。
(2)Mg3N2与水反应属于__________ (填基本反应类型),写出该反应的化学方程式:_____________。
(3)Mg2+与N3-的半径关系是Mg2+_____(填“>”、“<” 或“=”)N3-。
(4)Mg3N2与盐酸的反应生成_____种盐,用电子式表示其中只含有离子键的盐的形成过程_____,写出另一种盐的电子式_____。
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:2015-2016学年山东省高二下期中化学试卷(解析版) 题型:推断题
对羟基甲苯甲酸丁酯可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.如图是某课题组开发的廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线
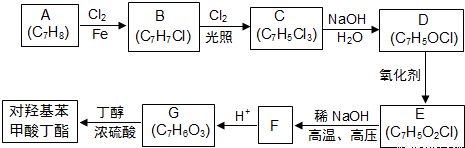
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1:1.
回答下列问题:
(1)B的名称为_______.
(2)D与银氨溶液反应的化学方程式为_______。
(3)由E生成F的化学方程式为_______。
(4)E与乙醇在浓硫酸加热条件下的反应方程式为_______。
(5)G的结构简式为_______。
(6)区别G和E所用试剂为_______。
(7)E的同分异构体中含有苯环且能发生银镜反应,并与FeCl3溶液发生显色反应的有_______种。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.已知冰的熔化热为6.0 kJ • mol-1,冰中氢键键能为20 kJ • mol-1,假设1 mol 冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15 %的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a, 电离常数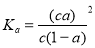 。若加水稀释,则CH3COOH
。若加水稀释,则CH3COOH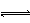 CH3C00-+H+向右移动,a增大, Ka不变
CH3C00-+H+向右移动,a增大, Ka不变
C.甲烷的标准燃烧热为-890.3 kjJ• mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-890.3 kJ • mol-1
D.500℃、30 MPa下,将0.5 mol N和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:
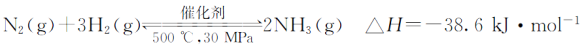
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀硫酸反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是
A.1 B.3 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期中化学试卷(解析版) 题型:选择题
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
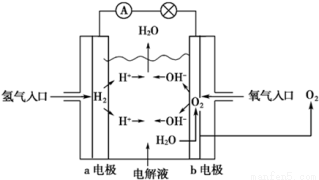
A.a电极是负极
B.b电极的电极反应为:4OH - -4e - ==2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期中化学试卷(解析版) 题型:选择题
下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.2Na2O2+2H2O=4NaOH+O2↑
B.MgCl2+2NaOH=Mg(OH)2↓+2NaCl
C.2NaOH +Cl2 = NaOCl +H2O
D.NH4Cl+NaOH=NaCl+NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:计算题
由铜片、铁片和50mL稀硫酸组成的原电池中,当通过导线的电子为0.3mol时(铁片上无气体产生),硫酸恰好反应完.列式计算:
(1)产生这些气体消耗的金属是哪一种,消耗的质量是多少;
(2)铜片上放出多少L(标准状况)气体;
(3)硫酸溶液的物质的量浓度是多少。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第六次适应性考试理综化学试卷(解析版) 题型:填空题
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。
(1)基态氮原子的核外电子排布式为 。
(2)与N互为等电子体的离子有 (任写一种)。
(3)工业上用氧化铝与氮气和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,其化学式为 ,工业制备X的化学方程式为______________________。
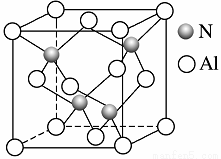
(4)X晶体中包含的化学键类型为________(填字母)。
A.共价键 B.配位键 C.离子键 D.金属键
X晶体中氮原子的杂化类型为________杂化。
(5)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是
。
(6)若X的密度为ρ g·cm-3,则晶体中最近的两个Al原子的距离为 cm。(阿伏加德罗常数的值用NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com