
分析 铝离子在溶液中水解使溶液显酸性,加热促进水解同时生成的HCl挥发,使水解进行到底;铝离子与硫离子能发生双水解反应.
解答 解:氯化铝为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O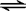 Al(OH)3+3H+,水解后溶液呈酸性,加热时促进水解,生成Al(OH)3,Al(OH)3不稳定,灼烧时分解生成Al2O3;将AlCl3溶液中加入硫化钠溶液,铝离子与硫离子能发生双水解反应,其反应的离子方程式为:2Al3++6H2O+3S2-=2Al(OH)3↓+3H2S↑;
Al(OH)3+3H+,水解后溶液呈酸性,加热时促进水解,生成Al(OH)3,Al(OH)3不稳定,灼烧时分解生成Al2O3;将AlCl3溶液中加入硫化钠溶液,铝离子与硫离子能发生双水解反应,其反应的离子方程式为:2Al3++6H2O+3S2-=2Al(OH)3↓+3H2S↑;
故答案为:酸性; Al3++3H2O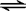 Al(OH)3+3H+;Al2O3; 2Al3++6H2O+3S2-=2Al(OH)3↓+3H2S↑.
Al(OH)3+3H+;Al2O3; 2Al3++6H2O+3S2-=2Al(OH)3↓+3H2S↑.
点评 本题考查盐类的水解,题目难度不大,注意水解平衡移动的影响因素.


科目:高中化学 来源: 题型:选择题
 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A. | 还原性:HSO${\;}_{3}^{-}$>I-,氧化性:IO${\;}_{3}^{-}$>I2>SO${\;}_{4}^{2-}$ | |
| B. | a点处的氧化产物是SO${\;}_{4}^{2-}$,还原产物是I- | |
| C. | 当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol | |
| D. | 若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO${\;}_{3}^{-}$+5HSO${\;}_{3}^{-}$═I2+5SO${\;}_{4}^{2-}$+3H++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 月球上的H2O分子中只含有非极性共价键 | |
| B. | H2O在化学反应中既可作氧化剂又可作还原剂 | |
| C. | 氢的三种同位素H、D、T与16O只能形成三种水分子 | |
| D. | 在标准状况下,1mol水的体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 往甲中通适量CO2有利于(NH4)2SO4生成 | |
| B. | 生成1 mol(NH4)2SO4至少消耗2 molNH3 | |
| C. | CO2可被循环利用 | |
| D. | NH3、CO2的通入顺序可以互换 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO$\stackrel{HCl(ag)}{→}$MgCl2(ag)$\stackrel{△}{→}$无水MgCl2 | |
| B. | Al2O3$\stackrel{NaOH(ag)}{→}$NaAlO2(ag)$\stackrel{HCl(ag)}{→}$AlCl3 | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 | |
| D. | Cu$\stackrel{稀HNO_{3}}{→}$NO2$\stackrel{H_{2}O}{→}$NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
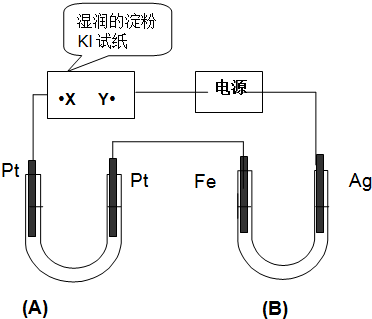
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com