
【题目】在我们的日常生活中出现了“加碘食盐”“铁强化酱油”“高钙牛奶”“含氟牙膏”等商品。这里的碘、铁、钙、氟应理解为
A.元素B.单质C.分子D.氧化物
科目:高中化学 来源: 题型:
【题目】游泳池的水变绿主要是因为细菌及藻类的急剧繁殖导致的。
(1)含氯物质可以作为游泳池的消毒剂。一般水质正常的游泳池消毒后水中的余氯应保持在0.3~0.5 mg/L,pH保持在7.4~7.6,这个环境下细菌和藻类都不易生长和繁殖。
①夏季,露天游泳池水由于连续下雨会导致藻类大量繁殖,其原因是_____________________。
②消毒剂的错误使用也会导致藻类大量繁殖,游泳池水变绿。若水中的余氯以次氯酸形式存在,再加入H2O2进行消毒也会导致池水变绿,写出次氯酸与H2O2发生反应生成盐酸的化学方程式____________________。
(2)处理池水变绿的方法分为五步。
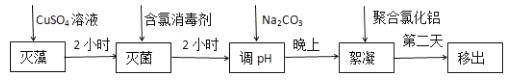
①灭藻原理是铜离子可以使叶绿体中毒无法光合作用而死亡,加入CuSO4溶液后需要打开水循环系统,其作用是__________________________。
②含氯消毒剂杀菌消毒主要体现出的化学性质是_________________。
③选用Na2CO3调节pH至7.5,用化学用语和文字解释其原因________________。
④ 聚合氯化铝可将悬浮物和被杀灭的细小藻类沉淀到池底,第二天将池底沉淀移出。稀释聚合氯化铝会产生胶体,其离子反应方程式是_____________________________;当温度大于80℃时,水体中铝离子的总浓度会降低,其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)下图中的实验装置可用于制取乙炔。请填空:

(1)图中,A管的作用是 。
制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是
A.Ca2+、Na+、NO3-、CO32-B.Mg2+、Cl-、 NH4+、SO42-
C.K+、Cl-、HCO3-、NO3-D.Ca2+、Na、 Fe3+、 NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |

回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式______。
写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大。A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数等于其电子层数,且为C元素原子最外层电子数的一半。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。 甲、乙、丙、丁四种物质之间的相互反应关系如下图:
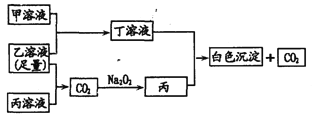
请回答:
(1)写出Na2O2的电子式___________;C在周期表中的位置____________。
(2)用有关化学用语解释丙溶液呈碱性的原因___________________________。
(3)写出甲溶液与足量乙溶液反应的离子方程式: ________________________。
(4)丙和丁因发生双水解而不能共存写出该反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,Y和Z相邻,Z原子的最外层电子数是次外层电子数的三倍,则
(1)写出下列元素名称:X是_____,Z是_____.Y在周期表中第____周期,第_____族。
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的分子式是______.
(3)写出由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种阴、阳离子______和______。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4:2:3,该盐的化学式是______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W、X、Y、Z原子的最外层电子数之和为21,下列说法中不正确的是

A. 原子半径:X>Y>W
B. 简单阴离子的还原性:Z>W
C. 气态氢化物的稳定性:W>Y
D. 氧化物对应水化物的酸性:Z>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com