
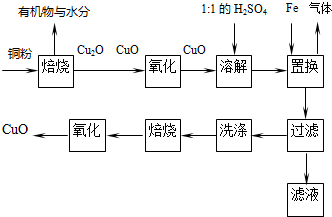
分析 铜粉焙烧生成Cu2O、CuO和有机物、水,Cu2O被氧化生成CuO,CuO和稀硫酸反应生成CuSO4,溶液中还存在硫酸,硫酸、CuSO4和Fe发生置换反应生成FeSO4,过滤得沉淀Cu,然后洗涤、焙烧、氧化得到CuO,
(1)用过量的铁把铜置换出来后,用盐酸和水洗去过量的铁和可溶性杂质;
(2)根据仪器的作用选取仪器;
(3)金属和浓硫酸反应生成二氧化硫;
(4)氧化亚铜和稀硫酸反应生成硫酸铜和铜单质,如果将固体加入稀硫酸中有红色物质生成,就说明含有氧化亚铜,氧化亚铜能还原硝酸生成一氧化氮,一氧化氮遇空气变为红棕色的二氧化氮,据此选择;
(5)根据铜原子守恒确定需要测定的数据.
解答 解:(1)用盐酸和水洗去铜中过量的铁和可溶性杂质;
故答案为:稀盐酸;水;
(2)配制硫酸时,需要烧杯盛放硫酸溶液,需要量筒量取浓硫酸,所以还需要烧杯、量筒,
故答案为:量筒;烧杯;
(3)浓硫酸和金属反应生成SO2,SO2属于酸性氧化物,能和水反应生成亚硫酸,且SO2有毒,不能直接排空,所以SO2要收集处理,
故答案为:SO2;
(4)氧化亚铜和稀硫酸反应生成CuSO4和Cu,将固体加入稀硫酸中,如果有红色物质生成,就说明含有氧化亚铜,否则没有氧化亚铜,其检验方法为:取少许样品,加入稀H2SO4,若溶液中存在红色固体,说明含有Cu2O,反之则没有,氧化亚铜能还原硝酸生成一氧化氮,一氧化氮遇空气变为红棕色的二氧化氮,如果出现无色气体(随即变成红棕色)产生,也可说明含有Cu2O,Cu2O、CuO都能溶于硫酸产生蓝色溶液,也都溶于硝酸,故选bc.
故答案为:b c;
(5)计算铜粉中Cu的含量,根据铜原子守恒知,不仅要知道铜粉的质量还要知道最终得到CuO的质量,
故答案为:铜粉的质量;最终所得CuO的质量.
点评 本题以铜为载体考查了物质的分离和提纯,涉及物质的检验、仪器的选取、物质间的反应等知识点,明确原理是解本题关键,要从整体上分析工艺流程,知道每一步发生的反应、物质分离的方法等,题目难度中等.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:填空题
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
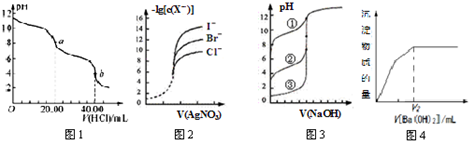
| A. | 图1是用0.l000 mol•L-1的盐酸滴定20.00 mL 0.l000mol•L-1Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+=CO2↑+H2O | |
| B. | 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | |
| C. | 用0.1000 mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图3曲线确定①的酸性最强 | |
| D. | 图Ⅳ表示明矾中滴入Ba(OH)2溶液,图中的V2表示生成的氢氧化铝恰好溶解时加入Ba(OH)2溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
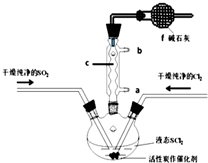 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 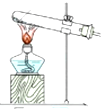 |  | 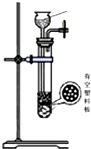 | 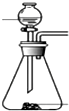 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
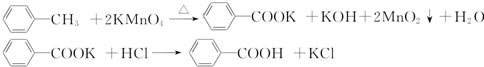
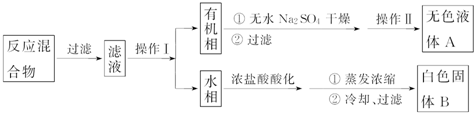
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入稀HNO3酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com