
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 根据氢氧化铜的溶度积:Ksp=c(Cu2+)•[c(OH-)]2计算出生成氢氧化铜沉淀时氢氧根离子的浓度,然后根据水的离子积计算出氢离子浓度,最后根据氢离子浓度得出溶液的pH.
解答 解:氢氧化铜的溶度积:Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则氢氧根离子的物质的量浓度至少为:c(0H-)=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$mol/L=1×10-9mol/L,
所以溶液中氢离子浓度为:c(H+)=$\frac{1×1{0}^{-14}}{1×1{0}^{-9}}$mol/L=10-5mol/L,
所以溶液的pH=5,若要生成Cu(OH)2沉淀,应调整溶液pH>5,
故选D.
点评 本题考查了难溶电解质的沉淀溶解平衡的简单计算,题目难度中等,注意掌握溶度积的概念、表达式,能够根据溶液中的离子浓度进行简单的溶解平衡的计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
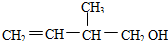 下列的叙述错误的是( )
下列的叙述错误的是( )| A. | 此有机物的官能团是羟基和碳碳双键 | |
| B. | 能在催化剂条件下与H2发生加成反应 | |
| C. | 此有机物不能发生加聚反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
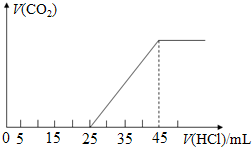
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验FeCl2溶液中的FeCl2是否被氧化 | 向该溶液中滴加硫氰化钾溶液 |
| B | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| C | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硫酸 |
| D | 证明CH2=CHCHO中含有醛基 | 向新制银氨溶液中滴少量丙烯醛并用水浴加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
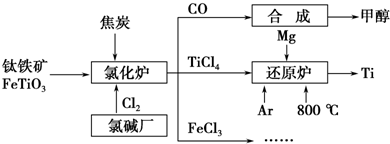
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(B+ )>c(A- )>c(OH- )>c(H+) | B. | c(A-)>c(B+ )>c(H+ )>c(OH-) | ||
| C. | c(B+)=c(A- )>c(H+)=c(OH-) | D. | c(B+ )>c(A- )>c(H+ )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池中,负极反应为N2H4-4e-═4H++N2 | |
| B. | 甲池溶液pH保持不变,乙池溶液pH减小 | |
| C. | 甲池中消耗2.24LO2,此时乙池中理论上最多产生12.8g固体 | |
| D. | 反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂电极作电池负极,放电过程中发生氧化反应 | |
| B. | 1molSOCl2发生电极反应转移的电子数为2mol | |
| C. | 电池的正极反应为2SOCl2+2e-═4Cl-+S+SO2 | |
| D. | 组装该电池必须在无水、无氧的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质的变性是不可逆的 | |
| B. | 在一定条件下,蛋白质水解的最终产物是氨基酸 | |
| C. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,震荡,若没有油滴浮在液面上,说明油脂已完全反应 | |
| D. | 检验淀粉在稀硫酸催化下水解程度的方法是:取适量水解液于试管中,加入少量碘水,若出现蓝色说明没有水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com