
【题目】某化学兴趣小组为探究SO2的性质,按如图I所示装置进行实验。请回答下列问题:

(1)装置A中发生反应的化学方程式________。
(2)实验过程中,装置B、C中发生反应的现象分别是__________、________。
(3)反应开始一段时间后,观察到D装置试管中的品红溶液褪色后,停止通气,再对该试管加热,其现象为______________。若将Cl2直接通入品红溶液待褪色后再加热其现象是否与上述相同_________(填“相同”或“不相同”)。
(4)下列物质中,可用于吸收烟气中含有的少量SO2的是_________(填序号)。
a.Na2CO3 b.H2SO4 c.NaHSO3 d.NH3·H2O
(5)该实验小组利用上述图II装置继续进行实验:通气一段时间后,实验过程中品红溶液几乎不褪色。试分析实验过程中,品红溶液几乎不褪色的原因是(用离子方程式表示): _____________。
【答案】 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 溶液由紫红色变为无色 无色溶液出现淡黄色浑浊 品红溶液又恢复为原来的红色 不相同 ad SO2+Cl2+2H20=4H++SO42-+2Cl-
【解析】(1)硫酸的酸性大于亚硫酸,根据强酸制取弱酸知,硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,反应方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;(2)酸性高锰酸钾具有强氧化性,通入二氧化硫后装置B中发生反应的现象是溶液由紫红色变为无色;硫化氢和二氧化硫反应生成硫单质,硫不易溶于水,通入二氧化硫后装置C中发生反应的现象是无色溶液出现淡黄色浑浊;(3)由于SO2的漂白性是可逆的,所以加热能使品红溶液恢复红色,故停止通气,再对该试管加热,其现象为品红溶液又恢复为原来的红色;但氯水的漂白性是氧化导致的,是不可逆的,加热不能恢复红色,现象不相同;(4)a.Na2CO3 溶液与SO2反应生成 亚硫酸钠和二氧化碳,可用于吸收烟气中含有的少量SO2,选项a选; b.H2SO4与SO2不反应,不可用于吸收烟气中含有的少量SO2,选项b不选;c.NaHSO3与SO2不反应,不可用于吸收烟气中含有的少量SO2,选项c不选;d.NH3·H2O与SO2反应生成亚硫酸铵,可用于吸收烟气中含有的少量SO2,选项d选;答案选ad;(5)二氧化硫与氯气按1:1溶于水后生成的硫酸和盐酸都无漂白性,品红溶液几乎不褪色的原因是SO2+Cl2+2H2O=4H++SO42-+2Cl-。


科目:高中化学 来源: 题型:
【题目】下列物质中,不能由单质直接化合生成的是( )
①CuS ②FeS ③SO3 ④H2S ⑤FeCl2 .
A.①③⑤
B.①②③⑤
C.①②④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去): 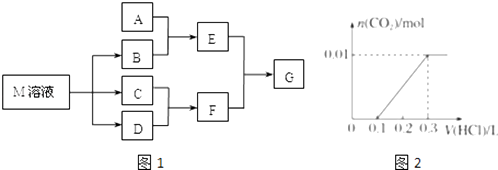
(1)写出用惰性电极电解M溶液的离子方程式 . 写出F的电子式 .
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 .
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图2所示,“则A与B溶液”反应后溶液中的溶质化学式为 .
(4)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸钾具有毒性,是一种常用的分析试剂和氧化剂,实验室中制备过程如下: 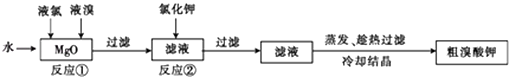
已知反应②是复分解反应,根据上述转化关系回答下列问题:
(1)反应①的化学方程式为 .
(2)反应②的化学方程式为 .
(3)现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示.请回答下列问题: 
①已知b点时,KI反应完全,转移的电子数为 .
②b→c过程中,仅有一种元素的化合价发生了变化.则反应时氧化剂与还原剂的物质的量之比为 .
③d点时,n(KBrO3)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A.H2+F2═2HF
B.3CO+Fe2O3 ![]() ?2Fe+3CO2
?2Fe+3CO2
C.NaOH+HCl═NaCl+H2O
D.4HNO3 ![]() ?2H2O+4NO2↑+O2↑
?2H2O+4NO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型、晶体类型都相同的是( )
A.CO2和SiO2B.H2S和H2OC.NaCl和HClD.CF2Cl2和CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时加水稀释10mL pH=11的氨水,下列判断正确的是( )
A.原氨水的浓度为10﹣3mol?L﹣1
B.溶液中 ![]() 减小
减小
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种制取纯碱的方法如下:

(1)写出“反应I ”的化学方程式:__。
(2)“反应Ⅱ”为复分解反应,反应中所涉及物质的溶解度如图所示。写出“反应Ⅱ”的化学方程式:__。

(3)写出“煅烧”反应的化学方程式:__。
(4) “蒸氨”时需要加热,写出“蒸氨”时反应的化学方程式:___。
(5)写出将“蒸氨”产生的氨气通入Al2(SO4)3溶液中时反应的离子方程式: __。
【答案】 NH3·H2O+CO2=NH4HCO3 NaCl+NH4HCO3=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+CO2↑+H2O 2NH4Cl+Ca(OH)2
Na2CO3+CO2↑+H2O 2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+
CaCl2+2NH3↑+2H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】(1)氨水显碱性,CO2为酸性氧化物,二者反应生成盐,CO2过量时生成酸式盐即碳酸氢铵,故化学方程式为:NH3·H2O+CO2=NH4HCO3。
(2)氨气极易溶于水,氨水的浓度非常大,可以溶解大量的氨气,则反应I得到浓度较大的碳酸氢铵溶液。向碳酸氢铵溶液中加入食盐后,溶液中主要存在四种离子:Na+、NH4+、HCO3-、Cl-,根据溶解度曲线可知,同温度下NaHCO3的溶解度最小,溶液中会析出晶体NaHCO3。反应II为复分解反应,则反应方程式为NaCl+NH4HCO3=NaHCO3↓+NH4Cl。
(3)过滤得到NaHCO3晶体,加热,NaHCO3分解为Na2CO3、H2O、CO2,反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4)向NH4Cl溶液中加入石灰乳,NH4+与OH-结合为NH3·H2O,加热条件下,促进NH3逸出,即为“蒸氨”,反应方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(5)氨气溶于水得NH3·H2O,NH3·H2O碱性强于Al(OH)3,故将NH3通入Al2(SO4)3溶液中有Al(OH)3沉淀生成,离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
【题型】综合题
【结束】
22
【题目】实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:

(1)“反应I”在加热条件下进行,同时有MnCl2生成,该反应的化学方程式为 __。
(2) “反应Ⅱ”中杂质与Cl2反应的化学方程式为__。 ⑶实验所用SO2气体可由铜和浓硫酸反应制得,该反应的化学方程式为__
(4)“反应Ⅲ”的离子方程式为___。
(5)若将等物质的量的S02、Cl2通入水中,所得溶液几乎没有漂白性,该反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com