
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水
④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①④
C.①③ D.②③
科目:高中化学 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:实验题
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液.向0.1mol·L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
实验二:向2mL FeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:________________。
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
Ⅲ.向2mL 0.1mol·L-1 FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明__________________;
②实验Ⅲ的目的是____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)①甲直接用FeCl2·4H2O配制_________mol·L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去,进一步探究其原因:
②.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH约为3.由此,乙认为红色不褪去的可能原因是:____________________。
③.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i | 生成白色沉淀 | |
ii | 向i所得溶液中滴加0.1mol·L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
普伐他汀是—种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关 于普伐他汀的描述不正确的是
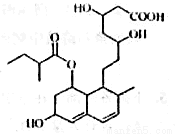
A.能使酸性KMnO4溶液褪色
B.能发生加成、取代、消去反应
C.其分子式为C23H35O7
D.1mol该物质最多可与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是

A.原电池的总反应为Fe+Cu2+═Fe2++Cu
B.盐桥中是KNO3溶液,则盐桥中NO3﹣移 向乙烧杯
向乙烧杯
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e﹣═H2↑
D.反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A.上述反应在较高温度下才能自发进行
B.该反应的正反应活化能小于逆反应活化能
C.该反应中,断裂化学键的总键能大于形成化学键的总键能
D.若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列与NA有关的说法正确的是
A.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,当得到标准状况下67.2 L Cl2时,反应中转移的电子数为6 NA
B.6.0 g SiO2晶体中含有的硅氧键数目为0.2 NA
C.标准状况下,22.4 L NO和11.2 L O2混合后气体的分子总数为NA
D.S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:填空题
已知2A2(g)+B2(g) 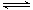 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
室温下,向10mL0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中粒子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦増大
D.溶液中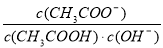 不变
不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一期中化学卷(解析版) 题型:选择题
下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是
A.化合反应一定是氧化还原反应
B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.复分解反应不一定是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com